La solubilité est utilisée en chimie pour décrire les propriétés d'un composé solide qui est mélangé avec un liquide et qui se dissout complètement sans laisser de particules non dissoutes. Seuls les composés ioniques (chargés) sont solubles. Pour des raisons pratiques, la mémorisation de quelques règles ou la liste de celles-ci suffit à vous dire si la plupart des composés ioniques resteront solides lorsqu'ils tombent dans l'eau ou si une quantité importante se dissoudra. En réalité, un certain nombre de molécules se dissoudront même si vous ne pouvez pas voir le changement. Pour des expériences précises, vous devrez peut-être savoir comment calculer cette quantité.
Méthode One of Two:
Utiliser les règles rapides
-
 1 En savoir plus sur les composés ioniques. Chaque atome a normalement un certain nombre d'électrons, mais parfois ils captent un électron supplémentaire ou en perdent un par un processus appelé transfert d'électrons.[1] Le résultat est un ion, qui a une charge électrique. Lorsqu'un ion avec une charge négative (un électron supplémentaire) rencontre un ion avec une charge positive (il lui manque un électron), ils se lient comme les extrémités négatives et positives des 2 aimants. Le résultat est un composé ionique.
1 En savoir plus sur les composés ioniques. Chaque atome a normalement un certain nombre d'électrons, mais parfois ils captent un électron supplémentaire ou en perdent un par un processus appelé transfert d'électrons.[1] Le résultat est un ion, qui a une charge électrique. Lorsqu'un ion avec une charge négative (un électron supplémentaire) rencontre un ion avec une charge positive (il lui manque un électron), ils se lient comme les extrémités négatives et positives des 2 aimants. Le résultat est un composé ionique. - Les ions avec des charges négatives sont appelés anions, tandis que les ions avec des charges positives sont cations.
- Normalement, le nombre d'électrons dans un atome est égal au nombre de protons, annulant les charges électriques.
-
 2 Comprendre la solubilité Molécules d'eau (H2O) ont une structure inhabituelle, ce qui les rend similaires à un aimant: une extrémité a une charge positive, tandis que l'autre a un négatif. Lorsque vous déposez un composé ionique dans l'eau, ces "aimants" d'eau se rassemblent autour de lui, essayant de séparer les ions positifs et négatifs.[2]
2 Comprendre la solubilité Molécules d'eau (H2O) ont une structure inhabituelle, ce qui les rend similaires à un aimant: une extrémité a une charge positive, tandis que l'autre a un négatif. Lorsque vous déposez un composé ionique dans l'eau, ces "aimants" d'eau se rassemblent autour de lui, essayant de séparer les ions positifs et négatifs.[2] - Certains composés ioniques ne sont pas très bien collés; ceux-ci sont soluble puisque l'eau les séparera et les dissoudra. D'autres composés sont liés plus fortement et sont insoluble car ils peuvent rester ensemble malgré les molécules d'eau.
- Certains composés ont des liaisons internes dont la force est similaire à celle de l'eau. On les appelle légèrement soluble, car une quantité importante de composés sera séparée, mais le reste restera ensemble.
-
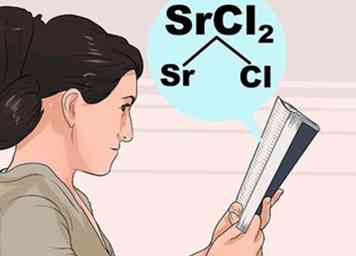 3 Étudiez les règles de solubilité. Les interactions entre atomes étant assez complexes, il n’est pas toujours intuitif de savoir quels composés sont solubles et quels sont ceux qui sont insolubles. Recherchez le premier ion du composé dans la liste ci-dessous pour savoir comment il se comporte habituellement, puis vérifiez les exceptions pour vous assurer que le second ion n'a pas une interaction inhabituelle.
3 Étudiez les règles de solubilité. Les interactions entre atomes étant assez complexes, il n’est pas toujours intuitif de savoir quels composés sont solubles et quels sont ceux qui sont insolubles. Recherchez le premier ion du composé dans la liste ci-dessous pour savoir comment il se comporte habituellement, puis vérifiez les exceptions pour vous assurer que le second ion n'a pas une interaction inhabituelle. - Par exemple, pour vérifier le chlorure de strontium (SrCl2), recherchez Sr ou Cl dans les étapes en gras ci-dessous. Cl est "généralement soluble", donc vérifiez en dessous des exceptions. Sr n'est pas répertorié comme une exception, donc SrCl2 doit être soluble.
- Les exceptions les plus courantes à chaque règle sont écrites en dessous. Il existe d'autres exceptions, mais il est peu probable que vous les rencontriez dans un cours ou un laboratoire de chimie typique.
-
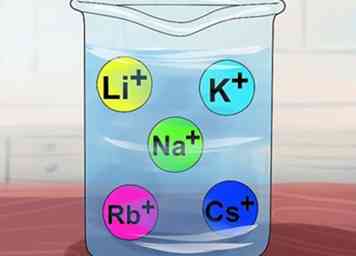 4 Reconnaître que les composés sont solubles s'ils contiennent des métaux alcalins. Les métaux alcalins comprennent le Li+, N / a+, K+, Rb+et Cs+. On les appelle également les éléments du groupe IA: lithium, sodium, potassium, rubidium et césium. Presque tous les composés qui contiennent l'un de ces ions sont solubles.
4 Reconnaître que les composés sont solubles s'ils contiennent des métaux alcalins. Les métaux alcalins comprennent le Li+, N / a+, K+, Rb+et Cs+. On les appelle également les éléments du groupe IA: lithium, sodium, potassium, rubidium et césium. Presque tous les composés qui contiennent l'un de ces ions sont solubles. - Exception: Li3PO4 est insoluble.
-
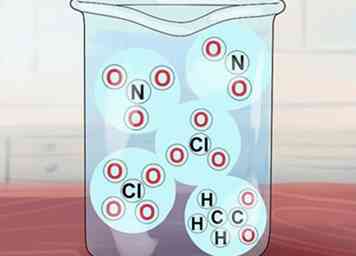 5 Comprenez que certains autres composés sont solubles. Ceux-ci comprennent des composés de NO3-C2H3O2-, NON2-, ClO3-et ClO4-. Respectivement, ce sont les ions nitrate, acétate, nitrite, chlorate et perchlorate. Notez que l'acétate est souvent abrégé en CAO.[3]
5 Comprenez que certains autres composés sont solubles. Ceux-ci comprennent des composés de NO3-C2H3O2-, NON2-, ClO3-et ClO4-. Respectivement, ce sont les ions nitrate, acétate, nitrite, chlorate et perchlorate. Notez que l'acétate est souvent abrégé en CAO.[3] - Des exceptions: Ag (OAc) (acétate d'argent) et Hg (OAc)2 (acétate de mercure) sont insolubles.
- AgNO2- et KClO4- ne sont que "légèrement solubles".
-
 6 Notez que les composés de Cl-, Br-, et moi- sont généralement solubles. Les ions chlorure, bromure et iodure forment presque toujours des composés solubles, appelés sels d'halogène.
6 Notez que les composés de Cl-, Br-, et moi- sont généralement solubles. Les ions chlorure, bromure et iodure forment presque toujours des composés solubles, appelés sels d'halogène. - Exception: Si l'un de ces paires avec les ions d'argent Ag+mercure Hg22+, ou plomb Pb2+, le résultat est insoluble. Il en va de même pour les composés moins courants issus du couplage avec du cuivre Cu+ et thallium Tl+.
-
 7 Réaliser que les composés contenant du SO42- sont généralement solubles. L'ion sulfate forme généralement des composés solubles, mais il existe plusieurs exceptions.
7 Réaliser que les composés contenant du SO42- sont généralement solubles. L'ion sulfate forme généralement des composés solubles, mais il existe plusieurs exceptions. - Des exceptions: L'ion sulfate forme des composés insolubles avec les ions suivants: strontium Sr2+, baryum Ba2+, plomb Pb2+, argent Ag+calcium Ca2+, radium Ra2+et argent diatomique Ag22+. Notez que le sulfate d'argent et le sulfate de calcium se dissolvent juste assez pour que certaines personnes les appellent légèrement solubles.
-
 8 Sachez que les composés contenant OH- ou S2- sont insolubles. Ce sont les ions hydroxyde et sulfure, respectivement.
8 Sachez que les composés contenant OH- ou S2- sont insolubles. Ce sont les ions hydroxyde et sulfure, respectivement. - Des exceptions: Rappelez-vous les métaux alcalins (groupe I-A) et comment ils aiment former des composés solubles? Li+, N / a+, K+, Rb+et Cs+ tous forment des composés solubles avec les ions hydroxyde ou sulfure. De plus, l'hydroxyde forme des sels solubles avec les ions alcalino-terreux (groupe II-A): calcium Ca2+strontium Sr2+et baryum Ba2+. Notez que les composés résultant de l'hydroxyde et d'une terre alcaline ont juste assez de molécules qui restent liées pour être parfois considérées comme "légèrement solubles".
-
 9 Comprendre que les composés contenant du CO32- ou PO43- sont insolubles. Une dernière vérification pour les ions carbonate et phosphate, et vous devez savoir à quoi vous attendre de votre composé.
9 Comprendre que les composés contenant du CO32- ou PO43- sont insolubles. Une dernière vérification pour les ions carbonate et phosphate, et vous devez savoir à quoi vous attendre de votre composé. - Des exceptions: Ces ions forment des composés solubles avec les suspects habituels, les métaux alcalins Li+, N / a+, K+, Rb+et Cs+, ainsi qu'avec de l'ammonium NH4+.
Méthode deux sur deux:
Calcul de la solubilité à partir du Ksp
-
 1 Recherchez la constante de solubilité du produit (Ksp). Cette constante est différente pour chaque composé, vous devrez donc rechercher un graphique dans votre manuel. Comme ces valeurs sont déterminées expérimentalement, elles peuvent varier considérablement d'un graphique à l'autre. Il est donc préférable d'utiliser le tableau de votre manuel s'il en existe un. Sauf indication contraire, la plupart des tableaux supposent que vous travaillez à 25ºC (77ºF).
1 Recherchez la constante de solubilité du produit (Ksp). Cette constante est différente pour chaque composé, vous devrez donc rechercher un graphique dans votre manuel. Comme ces valeurs sont déterminées expérimentalement, elles peuvent varier considérablement d'un graphique à l'autre. Il est donc préférable d'utiliser le tableau de votre manuel s'il en existe un. Sauf indication contraire, la plupart des tableaux supposent que vous travaillez à 25ºC (77ºF). - Par exemple, si vous dissolvez de l'iodure de plomb ou du PbI2, notez la constante de solubilité de son produit.
-
 2 Écrivez l'équation chimique. Tout d'abord, déterminez comment le composé se divise en ions lorsqu'il se dissout. Ensuite, écrivez une équation avec le Ksp d'un côté et les ions constitutifs de l'autre.
2 Écrivez l'équation chimique. Tout d'abord, déterminez comment le composé se divise en ions lorsqu'il se dissout. Ensuite, écrivez une équation avec le Ksp d'un côté et les ions constitutifs de l'autre. - Par exemple, une molécule de PbI2 se divise en ions Pb2+, JE-, et une seconde je-. (Vous devez seulement connaître ou rechercher la charge sur 1 ion, puisque vous savez que le composé total aura toujours une charge neutre.)
- Écrivez l'équation 7.1 × 10-9 = [Pb2+][JE-]2
- L'équation est la constante de solubilité du produit, que l'on peut trouver pour les 2 ions d'un diagramme de solubilité. Comme il y a 2 I- des ions, je- est à la deuxième puissance.
-
 3 Modifiez l'équation pour utiliser des variables. Réécrivez l'équation comme un simple problème d'algèbre, en utilisant ce que vous savez du nombre de molécules et d'ions. Fixez x à la quantité de composé qui va se dissoudre et réécrivez les variables représentant les nombres de chaque ion en termes de x.
3 Modifiez l'équation pour utiliser des variables. Réécrivez l'équation comme un simple problème d'algèbre, en utilisant ce que vous savez du nombre de molécules et d'ions. Fixez x à la quantité de composé qui va se dissoudre et réécrivez les variables représentant les nombres de chaque ion en termes de x. - Dans notre exemple, nous devons réécrire 7.1 × 10-9 = [Pb2+][JE-]2
- Comme il y a 1 ion de plomb (Pb2+) dans le composé, le nombre de molécules dissoutes sera égal au nombre d'ions plomb libres. Nous pouvons donc définir [Pb2+] à x.
- Comme il y a 2 ions iode (I-) pour chaque ion principal, on peut définir le nombre d'atomes d'iode égal à 2x au carré.
- L'équation est maintenant de 7,1 × 10-9 = (x) (2x)2
-
 4 Compte pour les ions communs, si présents. Ignorez cette étape si vous dissolvez le composé dans de l'eau pure. Si le composé est dissous dans une solution qui contient déjà un ou plusieurs des ions constitutifs (un "ion commun"), cependant, la solubilité est significativement réduite.[4] L'effet ionique commun est le plus notable dans les composés qui sont pour la plupart insolubles, et dans ces cas, on peut supposer que la grande majorité des ions à l'équilibre proviennent de l'ion déjà présent dans la solution. Réécrivez l'équation pour inclure la concentration molaire connue (moles par litre ou M) des ions déjà présents dans la solution, en remplaçant la valeur de x que vous avez utilisée pour cet ion.[5]
4 Compte pour les ions communs, si présents. Ignorez cette étape si vous dissolvez le composé dans de l'eau pure. Si le composé est dissous dans une solution qui contient déjà un ou plusieurs des ions constitutifs (un "ion commun"), cependant, la solubilité est significativement réduite.[4] L'effet ionique commun est le plus notable dans les composés qui sont pour la plupart insolubles, et dans ces cas, on peut supposer que la grande majorité des ions à l'équilibre proviennent de l'ion déjà présent dans la solution. Réécrivez l'équation pour inclure la concentration molaire connue (moles par litre ou M) des ions déjà présents dans la solution, en remplaçant la valeur de x que vous avez utilisée pour cet ion.[5] - Par exemple, si notre composé d'iodure de plomb était dissous dans une solution contenant 0,2 M de chlorure de plomb (PbCl2), nous réécririons notre équation comme 7.1 × 10-9 = (0,2 M + x) (2x)2. Alors, comme 0.2M est une concentration tellement supérieure à x, on peut le réécrire en toute sécurité comme 7.1 × 10-9 = (0,2M) (2x)2.
-
 5 Résous l'équation. Résoudre pour x, et vous saurez à quel point le composé est soluble. En raison de la façon dont la constante de solubilité est définie, votre réponse sera en termes de moles du composé dissous, par litre d'eau. Vous pourriez avoir besoin d'une calculatrice pour trouver la réponse finale.
5 Résous l'équation. Résoudre pour x, et vous saurez à quel point le composé est soluble. En raison de la façon dont la constante de solubilité est définie, votre réponse sera en termes de moles du composé dissous, par litre d'eau. Vous pourriez avoir besoin d'une calculatrice pour trouver la réponse finale. - Ce qui suit est pour la solubilité dans l'eau pure, pas avec des ions communs.
- 7.1×10-9 = (x) (2x)2
- 7.1×10-9 = (x) (4x2)
- 7.1×10-9 = 4x3
- (7.1×10-9) ÷ 4 = x3
- x = ∛ ((7.1 × 10-9) ÷ 4)
- x = 1,2 x 10-3 moles par litre se dissolvent. C'est une très petite quantité, donc vous savez que ce composé est essentiellement insoluble.
 Minotauromaquia
Minotauromaquia
 1 En savoir plus sur les composés ioniques. Chaque atome a normalement un certain nombre d'électrons, mais parfois ils captent un électron supplémentaire ou en perdent un par un processus appelé transfert d'électrons.[1] Le résultat est un ion, qui a une charge électrique. Lorsqu'un ion avec une charge négative (un électron supplémentaire) rencontre un ion avec une charge positive (il lui manque un électron), ils se lient comme les extrémités négatives et positives des 2 aimants. Le résultat est un composé ionique.
1 En savoir plus sur les composés ioniques. Chaque atome a normalement un certain nombre d'électrons, mais parfois ils captent un électron supplémentaire ou en perdent un par un processus appelé transfert d'électrons.[1] Le résultat est un ion, qui a une charge électrique. Lorsqu'un ion avec une charge négative (un électron supplémentaire) rencontre un ion avec une charge positive (il lui manque un électron), ils se lient comme les extrémités négatives et positives des 2 aimants. Le résultat est un composé ionique.  2 Comprendre la solubilité Molécules d'eau (H2O) ont une structure inhabituelle, ce qui les rend similaires à un aimant: une extrémité a une charge positive, tandis que l'autre a un négatif. Lorsque vous déposez un composé ionique dans l'eau, ces "aimants" d'eau se rassemblent autour de lui, essayant de séparer les ions positifs et négatifs.[2]
2 Comprendre la solubilité Molécules d'eau (H2O) ont une structure inhabituelle, ce qui les rend similaires à un aimant: une extrémité a une charge positive, tandis que l'autre a un négatif. Lorsque vous déposez un composé ionique dans l'eau, ces "aimants" d'eau se rassemblent autour de lui, essayant de séparer les ions positifs et négatifs.[2]  3 Étudiez les règles de solubilité. Les interactions entre atomes étant assez complexes, il n’est pas toujours intuitif de savoir quels composés sont solubles et quels sont ceux qui sont insolubles. Recherchez le premier ion du composé dans la liste ci-dessous pour savoir comment il se comporte habituellement, puis vérifiez les exceptions pour vous assurer que le second ion n'a pas une interaction inhabituelle.
3 Étudiez les règles de solubilité. Les interactions entre atomes étant assez complexes, il n’est pas toujours intuitif de savoir quels composés sont solubles et quels sont ceux qui sont insolubles. Recherchez le premier ion du composé dans la liste ci-dessous pour savoir comment il se comporte habituellement, puis vérifiez les exceptions pour vous assurer que le second ion n'a pas une interaction inhabituelle.  4 Reconnaître que les composés sont solubles s'ils contiennent des métaux alcalins. Les métaux alcalins comprennent le Li+, N / a+, K+, Rb+et Cs+. On les appelle également les éléments du groupe IA: lithium, sodium, potassium, rubidium et césium. Presque tous les composés qui contiennent l'un de ces ions sont solubles.
4 Reconnaître que les composés sont solubles s'ils contiennent des métaux alcalins. Les métaux alcalins comprennent le Li+, N / a+, K+, Rb+et Cs+. On les appelle également les éléments du groupe IA: lithium, sodium, potassium, rubidium et césium. Presque tous les composés qui contiennent l'un de ces ions sont solubles.  5 Comprenez que certains autres composés sont solubles. Ceux-ci comprennent des composés de NO3-C2H3O2-, NON2-, ClO3-et ClO4-. Respectivement, ce sont les ions nitrate, acétate, nitrite, chlorate et perchlorate. Notez que l'acétate est souvent abrégé en CAO.[3]
5 Comprenez que certains autres composés sont solubles. Ceux-ci comprennent des composés de NO3-C2H3O2-, NON2-, ClO3-et ClO4-. Respectivement, ce sont les ions nitrate, acétate, nitrite, chlorate et perchlorate. Notez que l'acétate est souvent abrégé en CAO.[3]  6 Notez que les composés de Cl-, Br-, et moi- sont généralement solubles. Les ions chlorure, bromure et iodure forment presque toujours des composés solubles, appelés sels d'halogène.
6 Notez que les composés de Cl-, Br-, et moi- sont généralement solubles. Les ions chlorure, bromure et iodure forment presque toujours des composés solubles, appelés sels d'halogène.  7 Réaliser que les composés contenant du SO42- sont généralement solubles. L'ion sulfate forme généralement des composés solubles, mais il existe plusieurs exceptions.
7 Réaliser que les composés contenant du SO42- sont généralement solubles. L'ion sulfate forme généralement des composés solubles, mais il existe plusieurs exceptions.  8 Sachez que les composés contenant OH- ou S2- sont insolubles. Ce sont les ions hydroxyde et sulfure, respectivement.
8 Sachez que les composés contenant OH- ou S2- sont insolubles. Ce sont les ions hydroxyde et sulfure, respectivement.  9 Comprendre que les composés contenant du CO32- ou PO43- sont insolubles. Une dernière vérification pour les ions carbonate et phosphate, et vous devez savoir à quoi vous attendre de votre composé.
9 Comprendre que les composés contenant du CO32- ou PO43- sont insolubles. Une dernière vérification pour les ions carbonate et phosphate, et vous devez savoir à quoi vous attendre de votre composé.  1 Recherchez la constante de solubilité du produit (Ksp). Cette constante est différente pour chaque composé, vous devrez donc rechercher un graphique dans votre manuel. Comme ces valeurs sont déterminées expérimentalement, elles peuvent varier considérablement d'un graphique à l'autre. Il est donc préférable d'utiliser le tableau de votre manuel s'il en existe un. Sauf indication contraire, la plupart des tableaux supposent que vous travaillez à 25ºC (77ºF).
1 Recherchez la constante de solubilité du produit (Ksp). Cette constante est différente pour chaque composé, vous devrez donc rechercher un graphique dans votre manuel. Comme ces valeurs sont déterminées expérimentalement, elles peuvent varier considérablement d'un graphique à l'autre. Il est donc préférable d'utiliser le tableau de votre manuel s'il en existe un. Sauf indication contraire, la plupart des tableaux supposent que vous travaillez à 25ºC (77ºF).  2 Écrivez l'équation chimique. Tout d'abord, déterminez comment le composé se divise en ions lorsqu'il se dissout. Ensuite, écrivez une équation avec le Ksp d'un côté et les ions constitutifs de l'autre.
2 Écrivez l'équation chimique. Tout d'abord, déterminez comment le composé se divise en ions lorsqu'il se dissout. Ensuite, écrivez une équation avec le Ksp d'un côté et les ions constitutifs de l'autre.  3 Modifiez l'équation pour utiliser des variables. Réécrivez l'équation comme un simple problème d'algèbre, en utilisant ce que vous savez du nombre de molécules et d'ions. Fixez x à la quantité de composé qui va se dissoudre et réécrivez les variables représentant les nombres de chaque ion en termes de x.
3 Modifiez l'équation pour utiliser des variables. Réécrivez l'équation comme un simple problème d'algèbre, en utilisant ce que vous savez du nombre de molécules et d'ions. Fixez x à la quantité de composé qui va se dissoudre et réécrivez les variables représentant les nombres de chaque ion en termes de x.  4 Compte pour les ions communs, si présents. Ignorez cette étape si vous dissolvez le composé dans de l'eau pure. Si le composé est dissous dans une solution qui contient déjà un ou plusieurs des ions constitutifs (un "ion commun"), cependant, la solubilité est significativement réduite.[4] L'effet ionique commun est le plus notable dans les composés qui sont pour la plupart insolubles, et dans ces cas, on peut supposer que la grande majorité des ions à l'équilibre proviennent de l'ion déjà présent dans la solution. Réécrivez l'équation pour inclure la concentration molaire connue (moles par litre ou M) des ions déjà présents dans la solution, en remplaçant la valeur de x que vous avez utilisée pour cet ion.[5]
4 Compte pour les ions communs, si présents. Ignorez cette étape si vous dissolvez le composé dans de l'eau pure. Si le composé est dissous dans une solution qui contient déjà un ou plusieurs des ions constitutifs (un "ion commun"), cependant, la solubilité est significativement réduite.[4] L'effet ionique commun est le plus notable dans les composés qui sont pour la plupart insolubles, et dans ces cas, on peut supposer que la grande majorité des ions à l'équilibre proviennent de l'ion déjà présent dans la solution. Réécrivez l'équation pour inclure la concentration molaire connue (moles par litre ou M) des ions déjà présents dans la solution, en remplaçant la valeur de x que vous avez utilisée pour cet ion.[5]  5 Résous l'équation. Résoudre pour x, et vous saurez à quel point le composé est soluble. En raison de la façon dont la constante de solubilité est définie, votre réponse sera en termes de moles du composé dissous, par litre d'eau. Vous pourriez avoir besoin d'une calculatrice pour trouver la réponse finale.
5 Résous l'équation. Résoudre pour x, et vous saurez à quel point le composé est soluble. En raison de la façon dont la constante de solubilité est définie, votre réponse sera en termes de moles du composé dissous, par litre d'eau. Vous pourriez avoir besoin d'une calculatrice pour trouver la réponse finale.