Une dilution en chimie est un processus qui réduit la concentration d'une substance dans une solution. Une dilution en série est la dilution répétée d'une solution pour amplifier rapidement le facteur de dilution.[1] Il est couramment utilisé dans des expériences nécessitant des solutions hautement diluées, telles que celles impliquant des courbes de concentration sur une échelle logarithmique ou lorsque vous déterminez la densité de bactéries. Les dilutions en série sont largement utilisées dans les sciences expérimentales telles que la biochimie, la microbiologie, la pharmacologie et la physique.
Méthode One of Two:
Effectuer une dilution de base
-
 1 Déterminer le liquide de dilution approprié. Le liquide que vous allez diluer dans votre substance est très important. De nombreuses solutions seront diluées dans de l'eau distillée, mais ce n'est pas toujours le cas. Si vous diluez des bactéries ou d'autres cellules, vous voudrez probablement diluer dans les milieux de culture.[2] Le liquide que vous choisissez sera utilisé pour chaque dilution en série.
1 Déterminer le liquide de dilution approprié. Le liquide que vous allez diluer dans votre substance est très important. De nombreuses solutions seront diluées dans de l'eau distillée, mais ce n'est pas toujours le cas. Si vous diluez des bactéries ou d'autres cellules, vous voudrez probablement diluer dans les milieux de culture.[2] Le liquide que vous choisissez sera utilisé pour chaque dilution en série. - Si vous ne savez pas quel liquide utiliser, demandez de l'aide ou vérifiez en ligne si d'autres personnes ont effectué une dilution similaire.
-
 2 Préparer plusieurs tubes à essai avec 9 ml de liquide de dilution. Ces tubes serviront de blancs de dilution.[3] Vous allez ajouter votre échantillon non dilué au premier tube et ensuite diluer en série dans les tubes suivants.
2 Préparer plusieurs tubes à essai avec 9 ml de liquide de dilution. Ces tubes serviront de blancs de dilution.[3] Vous allez ajouter votre échantillon non dilué au premier tube et ensuite diluer en série dans les tubes suivants. - Il est utile d'étiqueter tous vos tubes avant de commencer afin de ne pas être confus lorsque vous commencez avec les dilutions.
- Chaque tube aura une dilution de 10 fois à partir du tube non dilué.[4] Déterminez le nombre de dilutions à effectuer au préalable afin de ne pas gaspiller de tubes ou de diluer un liquide.
-
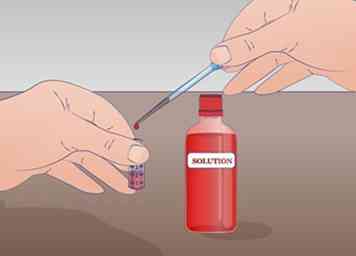 3 Préparez un tube à essai avec au moins 2 ml de votre solution non diluée. La quantité minimale requise pour effectuer cette dilution en série est de 1 mL de solution non diluée. Si vous n'avez que 1 mL, vous n'aurez plus de solution non diluée. Étiquetez ce tube NOUS pour solution non diluée.
3 Préparez un tube à essai avec au moins 2 ml de votre solution non diluée. La quantité minimale requise pour effectuer cette dilution en série est de 1 mL de solution non diluée. Si vous n'avez que 1 mL, vous n'aurez plus de solution non diluée. Étiquetez ce tube NOUS pour solution non diluée. - Bien mélanger votre solution avant de commencer toute dilution.[5]
-
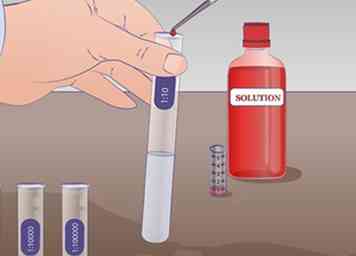 4 Effectuer la première dilution. Tirez 1 ml de solution non diluée du tube à essai NOUS avec une pipette et le transférer dans le tube à essai étiqueté 1:10 contenant 9 mL de liquide de dilution et bien mélanger. Il y a maintenant 1 ml de la solution non diluée dans 9 ml du liquide de dilution. La solution a donc été diluée d'un facteur 10.
4 Effectuer la première dilution. Tirez 1 ml de solution non diluée du tube à essai NOUS avec une pipette et le transférer dans le tube à essai étiqueté 1:10 contenant 9 mL de liquide de dilution et bien mélanger. Il y a maintenant 1 ml de la solution non diluée dans 9 ml du liquide de dilution. La solution a donc été diluée d'un facteur 10. -
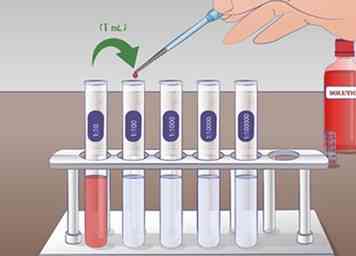 5 Effectuer la deuxième dilution. Pour la deuxième dilution en série, vous prendrez 1 mL de solution du tube 1:10 et l'ajouter aux 9 ml de liquide de dilution dans le tube 1:100. Bien mélanger le tube 1:10 avant d'ajouter au tube suivant. Encore une fois, mélanger le tube 1:100 après dilution. La solution du tube à essai 1:10 a été dilué 10 fois dans un tube à essai 1:100.
5 Effectuer la deuxième dilution. Pour la deuxième dilution en série, vous prendrez 1 mL de solution du tube 1:10 et l'ajouter aux 9 ml de liquide de dilution dans le tube 1:100. Bien mélanger le tube 1:10 avant d'ajouter au tube suivant. Encore une fois, mélanger le tube 1:100 après dilution. La solution du tube à essai 1:10 a été dilué 10 fois dans un tube à essai 1:100. -
 6 Étendre cette procédure pour effectuer des dilutions en série plus longues. Ce processus peut être répété autant de fois que nécessaire pour obtenir la solution souhaitée. Dans une expérience impliquant des courbes de concentration, vous pouvez utiliser une dilution en série pour créer une série de solutions avec des dilutions de 1, 1:10, 1: 100, 1: 1000.
6 Étendre cette procédure pour effectuer des dilutions en série plus longues. Ce processus peut être répété autant de fois que nécessaire pour obtenir la solution souhaitée. Dans une expérience impliquant des courbes de concentration, vous pouvez utiliser une dilution en série pour créer une série de solutions avec des dilutions de 1, 1:10, 1: 100, 1: 1000.
Méthode deux sur deux:
Calcul du facteur de dilution final et de la concentration
-
 1 Calculez le taux de dilution final dans une dilution en série. Le taux de dilution total peut être déterminé en multipliant le facteur de dilution de chaque étape menant à la dernière étape. Ceci peut être mathématiquement illustré avec l'équation rét = D1 x D2 x D3 x… x Dn où rét est le facteur de dilution total et rén est le taux de dilution.[6]
1 Calculez le taux de dilution final dans une dilution en série. Le taux de dilution total peut être déterminé en multipliant le facteur de dilution de chaque étape menant à la dernière étape. Ceci peut être mathématiquement illustré avec l'équation rét = D1 x D2 x D3 x… x Dn où rét est le facteur de dilution total et rén est le taux de dilution.[6] - Par exemple, disons que vous avez fait une dilution de 1:10 de votre liquide 4 fois. Branchez votre facteur de dilution dans l'équation: Dt = 10 x 10 x 10 x 10 = 10 000
- Le facteur de dilution final du quatrième tube de votre dilution en série est de 1: 10 000. La concentration de votre substance est maintenant 10 000 fois inférieure à la solution originale non diluée.
-
 2 Déterminer la concentration de la solution après dilution. Pour déterminer la concentration finale de votre solution après dilution en série, vous devrez connaître votre concentration initiale. L'équation est Cfinal = Cinitiale/RÉ où Cfinal est la concentration finale de la solution diluée, Cinitiale est la concentration de départ de la solution originale et ré est le taux de dilution déterminé précédemment.[7]
2 Déterminer la concentration de la solution après dilution. Pour déterminer la concentration finale de votre solution après dilution en série, vous devrez connaître votre concentration initiale. L'équation est Cfinal = Cinitiale/RÉ où Cfinal est la concentration finale de la solution diluée, Cinitiale est la concentration de départ de la solution originale et ré est le taux de dilution déterminé précédemment.[7] - Par exemple: Si vous avez commencé avec une solution de cellules avec une concentration de 1 000 000 cellules par ml et que votre taux de dilution est de 1 000, quelle est la concentration finale de votre échantillon dilué?
- En utilisant l'équation:
- Cfinal = Cinitiale/RÉ
- Cfinal = 1,000,000/1,000
- Cfinal = 1000 cellules par ml.
-
 3 Confirmez que toutes les unités correspondent. Lorsque vous effectuez un calcul, vous devez vous assurer que vos unités correspondent toujours à la fin.[8] Si vous avez commencé avec des cellules par ml, assurez-vous de terminer avec des cellules par ml. Si votre concentration de départ est de plusieurs parties par million (ppm), votre concentration finale doit être en ppm.
3 Confirmez que toutes les unités correspondent. Lorsque vous effectuez un calcul, vous devez vous assurer que vos unités correspondent toujours à la fin.[8] Si vous avez commencé avec des cellules par ml, assurez-vous de terminer avec des cellules par ml. Si votre concentration de départ est de plusieurs parties par million (ppm), votre concentration finale doit être en ppm.
 Minotauromaquia
Minotauromaquia
 1 Déterminer le liquide de dilution approprié. Le liquide que vous allez diluer dans votre substance est très important. De nombreuses solutions seront diluées dans de l'eau distillée, mais ce n'est pas toujours le cas. Si vous diluez des bactéries ou d'autres cellules, vous voudrez probablement diluer dans les milieux de culture.[2] Le liquide que vous choisissez sera utilisé pour chaque dilution en série.
1 Déterminer le liquide de dilution approprié. Le liquide que vous allez diluer dans votre substance est très important. De nombreuses solutions seront diluées dans de l'eau distillée, mais ce n'est pas toujours le cas. Si vous diluez des bactéries ou d'autres cellules, vous voudrez probablement diluer dans les milieux de culture.[2] Le liquide que vous choisissez sera utilisé pour chaque dilution en série.  2 Préparer plusieurs tubes à essai avec 9 ml de liquide de dilution. Ces tubes serviront de blancs de dilution.[3] Vous allez ajouter votre échantillon non dilué au premier tube et ensuite diluer en série dans les tubes suivants.
2 Préparer plusieurs tubes à essai avec 9 ml de liquide de dilution. Ces tubes serviront de blancs de dilution.[3] Vous allez ajouter votre échantillon non dilué au premier tube et ensuite diluer en série dans les tubes suivants.  3 Préparez un tube à essai avec au moins 2 ml de votre solution non diluée. La quantité minimale requise pour effectuer cette dilution en série est de 1 mL de solution non diluée. Si vous n'avez que 1 mL, vous n'aurez plus de solution non diluée. Étiquetez ce tube NOUS pour solution non diluée.
3 Préparez un tube à essai avec au moins 2 ml de votre solution non diluée. La quantité minimale requise pour effectuer cette dilution en série est de 1 mL de solution non diluée. Si vous n'avez que 1 mL, vous n'aurez plus de solution non diluée. Étiquetez ce tube NOUS pour solution non diluée.  4 Effectuer la première dilution. Tirez 1 ml de solution non diluée du tube à essai NOUS avec une pipette et le transférer dans le tube à essai étiqueté 1:10 contenant 9 mL de liquide de dilution et bien mélanger. Il y a maintenant 1 ml de la solution non diluée dans 9 ml du liquide de dilution. La solution a donc été diluée d'un facteur 10.
4 Effectuer la première dilution. Tirez 1 ml de solution non diluée du tube à essai NOUS avec une pipette et le transférer dans le tube à essai étiqueté 1:10 contenant 9 mL de liquide de dilution et bien mélanger. Il y a maintenant 1 ml de la solution non diluée dans 9 ml du liquide de dilution. La solution a donc été diluée d'un facteur 10.  5 Effectuer la deuxième dilution. Pour la deuxième dilution en série, vous prendrez 1 mL de solution du tube 1:10 et l'ajouter aux 9 ml de liquide de dilution dans le tube 1:100. Bien mélanger le tube 1:10 avant d'ajouter au tube suivant. Encore une fois, mélanger le tube 1:100 après dilution. La solution du tube à essai 1:10 a été dilué 10 fois dans un tube à essai 1:100.
5 Effectuer la deuxième dilution. Pour la deuxième dilution en série, vous prendrez 1 mL de solution du tube 1:10 et l'ajouter aux 9 ml de liquide de dilution dans le tube 1:100. Bien mélanger le tube 1:10 avant d'ajouter au tube suivant. Encore une fois, mélanger le tube 1:100 après dilution. La solution du tube à essai 1:10 a été dilué 10 fois dans un tube à essai 1:100.  6 Étendre cette procédure pour effectuer des dilutions en série plus longues. Ce processus peut être répété autant de fois que nécessaire pour obtenir la solution souhaitée. Dans une expérience impliquant des courbes de concentration, vous pouvez utiliser une dilution en série pour créer une série de solutions avec des dilutions de 1, 1:10, 1: 100, 1: 1000.
6 Étendre cette procédure pour effectuer des dilutions en série plus longues. Ce processus peut être répété autant de fois que nécessaire pour obtenir la solution souhaitée. Dans une expérience impliquant des courbes de concentration, vous pouvez utiliser une dilution en série pour créer une série de solutions avec des dilutions de 1, 1:10, 1: 100, 1: 1000.  1 Calculez le taux de dilution final dans une dilution en série. Le taux de dilution total peut être déterminé en multipliant le facteur de dilution de chaque étape menant à la dernière étape. Ceci peut être mathématiquement illustré avec l'équation rét = D1 x D2 x D3 x… x Dn où rét est le facteur de dilution total et rén est le taux de dilution.[6]
1 Calculez le taux de dilution final dans une dilution en série. Le taux de dilution total peut être déterminé en multipliant le facteur de dilution de chaque étape menant à la dernière étape. Ceci peut être mathématiquement illustré avec l'équation rét = D1 x D2 x D3 x… x Dn où rét est le facteur de dilution total et rén est le taux de dilution.[6]  2 Déterminer la concentration de la solution après dilution. Pour déterminer la concentration finale de votre solution après dilution en série, vous devrez connaître votre concentration initiale. L'équation est Cfinal = Cinitiale/RÉ où Cfinal est la concentration finale de la solution diluée, Cinitiale est la concentration de départ de la solution originale et ré est le taux de dilution déterminé précédemment.[7]
2 Déterminer la concentration de la solution après dilution. Pour déterminer la concentration finale de votre solution après dilution en série, vous devrez connaître votre concentration initiale. L'équation est Cfinal = Cinitiale/RÉ où Cfinal est la concentration finale de la solution diluée, Cinitiale est la concentration de départ de la solution originale et ré est le taux de dilution déterminé précédemment.[7]  3 Confirmez que toutes les unités correspondent. Lorsque vous effectuez un calcul, vous devez vous assurer que vos unités correspondent toujours à la fin.[8] Si vous avez commencé avec des cellules par ml, assurez-vous de terminer avec des cellules par ml. Si votre concentration de départ est de plusieurs parties par million (ppm), votre concentration finale doit être en ppm.
3 Confirmez que toutes les unités correspondent. Lorsque vous effectuez un calcul, vous devez vous assurer que vos unités correspondent toujours à la fin.[8] Si vous avez commencé avec des cellules par ml, assurez-vous de terminer avec des cellules par ml. Si votre concentration de départ est de plusieurs parties par million (ppm), votre concentration finale doit être en ppm.