La formule empirique d'un composé est l'expression écrite la plus simple de sa composition élémentaire. Vous devriez être en mesure de déterminer la formule empirique pour tout composé, à condition de connaître la masse de chaque élément présent, le pourcentage de masse de chaque élément présent ou la formule moléculaire du composé.
Méthode One of Three:
Première méthode: utiliser les pourcentages de poids [1]
-
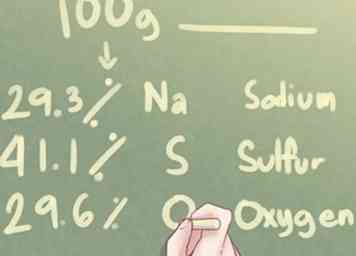 1 Regardez les données. Si on vous donne la composition élémentaire d'un composé inconnu en pourcentages plutôt qu'en grammes, vous devez supposer qu'il y a exactement 100,0 grammes de la substance en cause.
1 Regardez les données. Si on vous donne la composition élémentaire d'un composé inconnu en pourcentages plutôt qu'en grammes, vous devez supposer qu'il y a exactement 100,0 grammes de la substance en cause. - Ce sont les instructions à suivre si ce qui précède est vrai. Si vous recevez la composition élémentaire d'une substance inconnue en grammes, consultez la section «Utilisation du poids en grammes».
- Exemple: Déterminer la formule empirique d'un composé composé de 29,3% Na (sodium), 41,1% S (soufre) et 29,6% O (oxygène).
-
 2 Détermine le nombre de grammes pour chaque élément. En supposant qu'il existe 100 grammes de substance inconnue, vous pouvez déterminer que le nombre de grammes présents pour chaque élément est égal au pourcentage de chaque élément mentionné dans le problème.
2 Détermine le nombre de grammes pour chaque élément. En supposant qu'il existe 100 grammes de substance inconnue, vous pouvez déterminer que le nombre de grammes présents pour chaque élément est égal au pourcentage de chaque élément mentionné dans le problème. - Exemple: Pour 100 g de substance inconnue, il y a 29,3 g de Na, 41,1 g de S et 29,6 g de O.
-
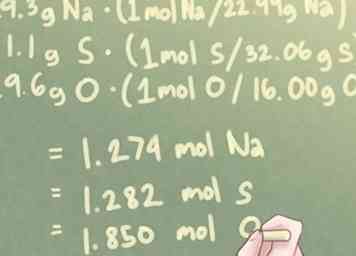 3 Convertir la masse de chaque élément en moles. La masse de chaque élément de votre composition, actuellement exprimée en grammes, devra être convertie en moles. Pour ce faire, chaque masse doit être multipliée par le rapport molaire selon leurs poids atomiques respectifs.
3 Convertir la masse de chaque élément en moles. La masse de chaque élément de votre composition, actuellement exprimée en grammes, devra être convertie en moles. Pour ce faire, chaque masse doit être multipliée par le rapport molaire selon leurs poids atomiques respectifs. - En termes plus simples, vous devrez diviser chaque masse par le poids atomique de cet élément.
- Notez également que les poids atomiques utilisés dans ce calcul doivent inclure au moins quatre chiffres significatifs.
- Exemple: Pour un composé contenant 29,3 g de Na, 41,1 g de S et 29,6 g de O:
- 29,3 g Na * (1 mol S / 22,99 g Na) = 1,274 mol Na
- 41,1 g S * (1 mol S / 32,06 g S) = 1,282 mol S
- 29,6 g O * (1 mol O / 16,00 g O) = 1,850 mol O
-
 4 Divisez chaque valeur de mole par le plus petit nombre de moles présentes. Vous aurez besoin d'un stochiométrique comparaison entre les éléments de votre composé, ce qui signifie essentiellement que vous devez calculer la quantité d'un élément que vous avez par rapport aux autres éléments présents dans votre composé. Pour ce faire, divisez chaque nombre de moles par le plus petit nombre de moles présentes.
4 Divisez chaque valeur de mole par le plus petit nombre de moles présentes. Vous aurez besoin d'un stochiométrique comparaison entre les éléments de votre composé, ce qui signifie essentiellement que vous devez calculer la quantité d'un élément que vous avez par rapport aux autres éléments présents dans votre composé. Pour ce faire, divisez chaque nombre de moles par le plus petit nombre de moles présentes. - Exemple: Le plus petit nombre de moles présentes dans le composé est de 1,274 mole (le nombre de moles pour Na, sodium).
- 1,274 mole Na / 1,274 mole = 1000 Na
- 1,282 mol S / 1,274 mol = 1,006 S
- 1,850 mol O / 1,274 mol = 1,452 O
- Exemple: Le plus petit nombre de moles présentes dans le composé est de 1,274 mole (le nombre de moles pour Na, sodium).
-
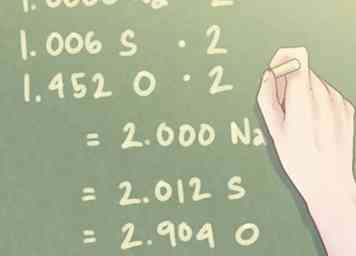 5 Multipliez les valeurs de rapport pour trouver des nombres entiers proches. La quantité de taupes présente pour chaque élément peut ne pas être égale à des nombres entiers. Pour les petites valeurs à moins d'un dixième de la valeur d'un nombre entier, cela ne pose pas de problème. Une fois que vous avez une valeur excédentaire supérieure à ce montant, vous devez toutefois multiplier les valeurs de ratio pour amener cette valeur à un nombre entier.
5 Multipliez les valeurs de rapport pour trouver des nombres entiers proches. La quantité de taupes présente pour chaque élément peut ne pas être égale à des nombres entiers. Pour les petites valeurs à moins d'un dixième de la valeur d'un nombre entier, cela ne pose pas de problème. Une fois que vous avez une valeur excédentaire supérieure à ce montant, vous devez toutefois multiplier les valeurs de ratio pour amener cette valeur à un nombre entier. - Si un élément a une valeur proche de 0,5, multipliez chaque élément par 2. De même, si un élément a une valeur proche de 0,25, multipliez chaque élément par 4.
- Exemple: Puisque la quantité d'oxygène (O) présente est proche de 1,5, vous devrez multiplier chaque valeur par «2» pour rapprocher le rapport de l'oxygène d'un nombre entier.
- 1.000 Na * 2 = 2.000 Na
- 1.006 S * 2 = 2.012 S
- 1,452 O * 2 = 2,904 O
-
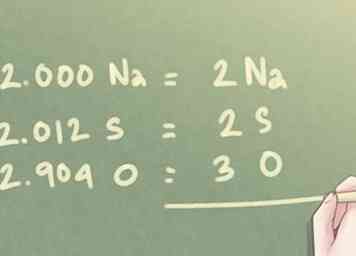 6 Arrondissez les valeurs aux nombres entiers les plus proches. Même après la dernière étape, la quantité de moles présente pour chaque élément peut ne pas être en nombres entiers exacts. Comme aucune décimale n'est utilisée dans les formules empiriques, vous devrez arrondir chaque valeur au nombre entier le plus proche.
6 Arrondissez les valeurs aux nombres entiers les plus proches. Même après la dernière étape, la quantité de moles présente pour chaque élément peut ne pas être en nombres entiers exacts. Comme aucune décimale n'est utilisée dans les formules empiriques, vous devrez arrondir chaque valeur au nombre entier le plus proche. - Exemple: Pour le ratio déterminé à l'étape précédente:
- 2.000 Na peut être écrit comme 2 Na.
- 2.012 S peut être arrondi à 2 S.
- 2.904 O peut être arrondi à 3 O.
- Exemple: Pour le ratio déterminé à l'étape précédente:
-
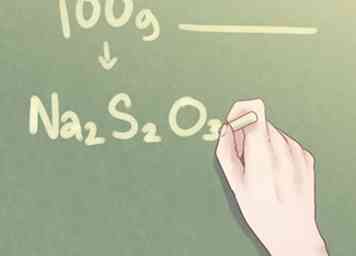 7 Écrivez votre réponse finale. Traduire le ratio d'éléments dans le format standard utilisé pour la formule empirique. La quantité moléculaire de chaque élément doit être indiquée en indice à côté du symbole de son élément respectif pour toutes les quantités supérieures à un.
7 Écrivez votre réponse finale. Traduire le ratio d'éléments dans le format standard utilisé pour la formule empirique. La quantité moléculaire de chaque élément doit être indiquée en indice à côté du symbole de son élément respectif pour toutes les quantités supérieures à un. - Exemple: Pour un composé composé de 2 parties de Na, 2 parties de S et 3 parties de O, la formule empirique devrait être écrite comme suit: Na2S2O3
Méthode deux sur trois:
Deuxième méthode: utiliser le poids en grammes
-
 1 Considérez le nombre de grammes. Si l'on vous donne la composition élémentaire d'une substance inconnue en grammes, vous devrez procéder selon les instructions suivantes.
1 Considérez le nombre de grammes. Si l'on vous donne la composition élémentaire d'une substance inconnue en grammes, vous devrez procéder selon les instructions suivantes. - En revanche, si vous recevez la composition en pourcentages au lieu de grammes, reportez-vous aux instructions de la section "Utilisation des pourcentages de poids".
- Exemple: Déterminer la formule empirique d'une substance inconnue composée de 8,5 g de fer (fer) et de 3,8 g d'oxygène (oxygène).
-
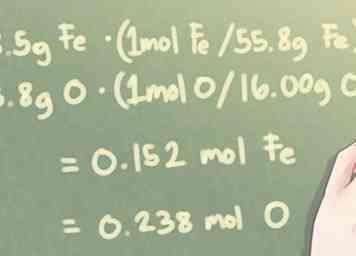 2 Convertir la masse de chaque élément en moles. Pour déterminer le rapport moléculaire des éléments dans le composé, vous devez convertir la quantité de chaque élément de grammes en moles. Faites-le en divisant la masse en grammes pour chaque élément par les poids atomiques respectifs des éléments.
2 Convertir la masse de chaque élément en moles. Pour déterminer le rapport moléculaire des éléments dans le composé, vous devez convertir la quantité de chaque élément de grammes en moles. Faites-le en divisant la masse en grammes pour chaque élément par les poids atomiques respectifs des éléments. - D'un point de vue plus technique, vous multipliez en fait la masse en grammes par le rapport molaire par poids atomique.
- Notez que la masse atomique doit être arrondie à quatre endroits significatifs pour maintenir un certain degré de précision dans vos calculs.
- Exemple: Quand il y a 8,5 g Fe et 3,8 g O:
- 8,5 g Fe * (1 mol Fe / 55,85 g Fe) = 0,152 mol Fe
- 3,8 g O * (1 mol O / 16,00 g O) = 0,238 mol O
-
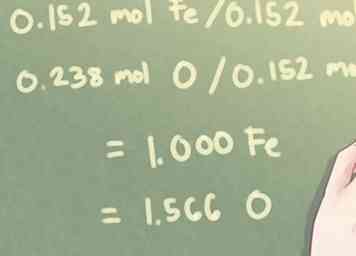 3 Diviser chaque valeur de mole par le plus petit nombre calculé. Déterminez combien de chaque élément est présent par rapport aux autres éléments du composé.Afin de calculer cela, vous devrez identifier le plus petit nombre de taupes présentes et diviser chaque nombre de taupes par ce nombre.
3 Diviser chaque valeur de mole par le plus petit nombre calculé. Déterminez combien de chaque élément est présent par rapport aux autres éléments du composé.Afin de calculer cela, vous devrez identifier le plus petit nombre de taupes présentes et diviser chaque nombre de taupes par ce nombre. - Exemple: Pour ce problème, la plus petite quantité de moles présente est de 0,152 mole (la quantité de Fe, de fer, présente).
- 0,152 mol Fe / 0,152 mol = 1000 Fe
- 0,238 mol O / 0,152 mol = 1,566 O
- Exemple: Pour ce problème, la plus petite quantité de moles présente est de 0,152 mole (la quantité de Fe, de fer, présente).
-
 4 Multipliez les valeurs de rapport pour trouver des nombres entiers proches. Souvent, les grains de beauté présents pour chaque substance peuvent ne pas correspondre à un nombre entier. Si l'excédent est à moins d'un dixième, vous pouvez simplement arrondir le tout. Pour les valeurs excédentaires qui dépassent cette valeur, vous devrez toutefois multiplier chaque valeur par un nombre pouvant ramener la valeur du rapport à un nombre entier.
4 Multipliez les valeurs de rapport pour trouver des nombres entiers proches. Souvent, les grains de beauté présents pour chaque substance peuvent ne pas correspondre à un nombre entier. Si l'excédent est à moins d'un dixième, vous pouvez simplement arrondir le tout. Pour les valeurs excédentaires qui dépassent cette valeur, vous devrez toutefois multiplier chaque valeur par un nombre pouvant ramener la valeur du rapport à un nombre entier. - Par exemple, si un élément a un excès de près de 0,25, multipliez chaque élément par 4. Si un élément a un excès de près de 0,5, multipliez chaque élément par 2.
- Exemple: Étant donné que la quantité d'oxygène est égale à 1,566, vous devrez multiplier les deux ratios par 2.
- 1.000 Fe * 2 = 2.000 Fe
- 1,566 O * 2 = 3,132 O
-
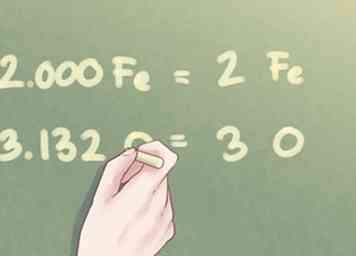 5 Arrondissez votre réponse au nombre entier le plus proche. Une fois que les valeurs de ratio de tous les éléments du composé sont à peu près égales à un dixième de nombre entier, vous pouvez arrondir toute différence au nombre entier le plus proche.
5 Arrondissez votre réponse au nombre entier le plus proche. Une fois que les valeurs de ratio de tous les éléments du composé sont à peu près égales à un dixième de nombre entier, vous pouvez arrondir toute différence au nombre entier le plus proche. - Exemple: La quantité de Fe peut être écrite comme 2. La quantité de O peut être arrondie à 3.
-
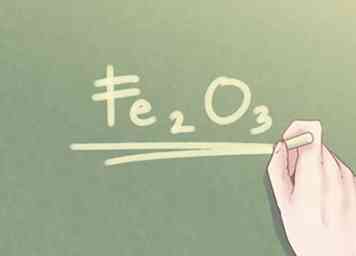 6 Écrivez la réponse finale. Le rapport des éléments doit être réécrit sous forme de formule empirique. Chaque valeur de rapport doit être indiquée en indice à côté du symbole de son élément respectif, sauf si la valeur du rapport est égale à un.
6 Écrivez la réponse finale. Le rapport des éléments doit être réécrit sous forme de formule empirique. Chaque valeur de rapport doit être indiquée en indice à côté du symbole de son élément respectif, sauf si la valeur du rapport est égale à un. - Exemple: Pour un composé de 2 parties Fe et 3 parties O, la formule empirique est: Fe2O3
Méthode trois sur trois:
Méthode trois: Utilisation de la formule moléculaire [2]
-
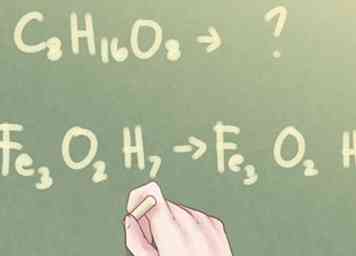 1 Déterminez si les indices peuvent être réduits. Si vous avez la formule moléculaire d'un composé inconnu mais que l'on vous demande d'identifier le composé par sa formule empirique, vous devez déterminer si la formule peut être réduite. Regardez les indices pour chaque élément présent. Si les trois indices partagent au moins un facteur commun (autre que le nombre 1), vous devrez suivre quelques étapes supplémentaires pour déterminer la formule empirique du composé.
1 Déterminez si les indices peuvent être réduits. Si vous avez la formule moléculaire d'un composé inconnu mais que l'on vous demande d'identifier le composé par sa formule empirique, vous devez déterminer si la formule peut être réduite. Regardez les indices pour chaque élément présent. Si les trois indices partagent au moins un facteur commun (autre que le nombre 1), vous devrez suivre quelques étapes supplémentaires pour déterminer la formule empirique du composé. - Exemple: C8H16O8
- En revanche, si les indices ne partagent pas tous un facteur commun, la formule moléculaire est également la formule empirique.
- Exemple: Fe3O2H7
-
 2 Trouvez le plus grand facteur commun entre les indices. Écrivez les facteurs de chaque indice dans votre formule. Identifiez le facteur qui a la plus grande valeur.
2 Trouvez le plus grand facteur commun entre les indices. Écrivez les facteurs de chaque indice dans votre formule. Identifiez le facteur qui a la plus grande valeur. - Exemple: Pour C8H16O8, les indices sont "16" et "8."
- Les facteurs de 8 sont: 1, 2, 4, 8
- Les facteurs de 16 sont: 1, 2, 4, 8, 16
- Le plus grand facteur commun (GCF) entre les deux nombres est 8.
- Exemple: Pour C8H16O8, les indices sont "16" et "8."
-
 3 Divisez chaque indice par le plus grand facteur commun. Pour obtenir chaque indice dans sa forme la plus simple, vous devrez diviser tous les indices présents dans la formule par le GCF que vous venez de trouver.
3 Divisez chaque indice par le plus grand facteur commun. Pour obtenir chaque indice dans sa forme la plus simple, vous devrez diviser tous les indices présents dans la formule par le GCF que vous venez de trouver. - Exemple: Pour C8H16O8:
- Diviser l'indice de 8 par le GCF de 8: 8/8 = 1
- Diviser l'indice de 16 par le GCF de 8: 16/8 = 2
- Exemple: Pour C8H16O8:
-
 4 Écrivez la réponse finale. Remplacez vos indices d'origine par leurs valeurs simplifiées. Ce faisant, vous avez déterminé la formule empirique du composé à partir de sa formule moléculaire.
4 Écrivez la réponse finale. Remplacez vos indices d'origine par leurs valeurs simplifiées. Ce faisant, vous avez déterminé la formule empirique du composé à partir de sa formule moléculaire. - Notez que les valeurs de 1 ne sont généralement pas indiquées avec des indices.
- Exemple: C8H16O8 = CH2O
 Minotauromaquia
Minotauromaquia
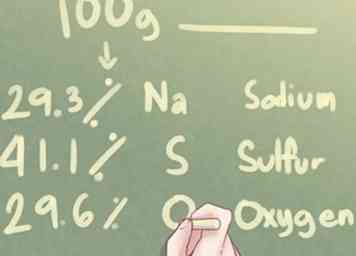 1 Regardez les données. Si on vous donne la composition élémentaire d'un composé inconnu en pourcentages plutôt qu'en grammes, vous devez supposer qu'il y a exactement 100,0 grammes de la substance en cause.
1 Regardez les données. Si on vous donne la composition élémentaire d'un composé inconnu en pourcentages plutôt qu'en grammes, vous devez supposer qu'il y a exactement 100,0 grammes de la substance en cause.  2 Détermine le nombre de grammes pour chaque élément. En supposant qu'il existe 100 grammes de substance inconnue, vous pouvez déterminer que le nombre de grammes présents pour chaque élément est égal au pourcentage de chaque élément mentionné dans le problème.
2 Détermine le nombre de grammes pour chaque élément. En supposant qu'il existe 100 grammes de substance inconnue, vous pouvez déterminer que le nombre de grammes présents pour chaque élément est égal au pourcentage de chaque élément mentionné dans le problème. 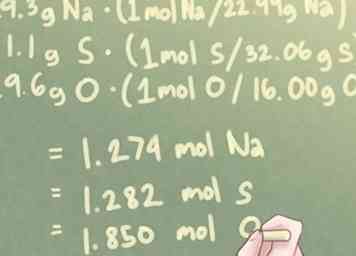 3 Convertir la masse de chaque élément en moles. La masse de chaque élément de votre composition, actuellement exprimée en grammes, devra être convertie en moles. Pour ce faire, chaque masse doit être multipliée par le rapport molaire selon leurs poids atomiques respectifs.
3 Convertir la masse de chaque élément en moles. La masse de chaque élément de votre composition, actuellement exprimée en grammes, devra être convertie en moles. Pour ce faire, chaque masse doit être multipliée par le rapport molaire selon leurs poids atomiques respectifs.  4 Divisez chaque valeur de mole par le plus petit nombre de moles présentes. Vous aurez besoin d'un stochiométrique comparaison entre les éléments de votre composé, ce qui signifie essentiellement que vous devez calculer la quantité d'un élément que vous avez par rapport aux autres éléments présents dans votre composé. Pour ce faire, divisez chaque nombre de moles par le plus petit nombre de moles présentes.
4 Divisez chaque valeur de mole par le plus petit nombre de moles présentes. Vous aurez besoin d'un stochiométrique comparaison entre les éléments de votre composé, ce qui signifie essentiellement que vous devez calculer la quantité d'un élément que vous avez par rapport aux autres éléments présents dans votre composé. Pour ce faire, divisez chaque nombre de moles par le plus petit nombre de moles présentes. 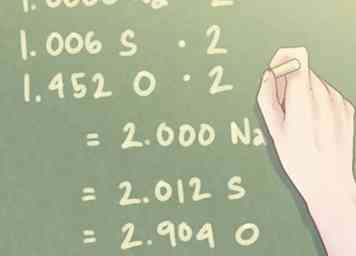 5 Multipliez les valeurs de rapport pour trouver des nombres entiers proches. La quantité de taupes présente pour chaque élément peut ne pas être égale à des nombres entiers. Pour les petites valeurs à moins d'un dixième de la valeur d'un nombre entier, cela ne pose pas de problème. Une fois que vous avez une valeur excédentaire supérieure à ce montant, vous devez toutefois multiplier les valeurs de ratio pour amener cette valeur à un nombre entier.
5 Multipliez les valeurs de rapport pour trouver des nombres entiers proches. La quantité de taupes présente pour chaque élément peut ne pas être égale à des nombres entiers. Pour les petites valeurs à moins d'un dixième de la valeur d'un nombre entier, cela ne pose pas de problème. Une fois que vous avez une valeur excédentaire supérieure à ce montant, vous devez toutefois multiplier les valeurs de ratio pour amener cette valeur à un nombre entier. 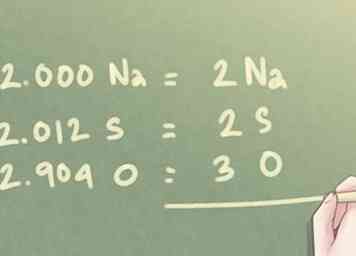 6 Arrondissez les valeurs aux nombres entiers les plus proches. Même après la dernière étape, la quantité de moles présente pour chaque élément peut ne pas être en nombres entiers exacts. Comme aucune décimale n'est utilisée dans les formules empiriques, vous devrez arrondir chaque valeur au nombre entier le plus proche.
6 Arrondissez les valeurs aux nombres entiers les plus proches. Même après la dernière étape, la quantité de moles présente pour chaque élément peut ne pas être en nombres entiers exacts. Comme aucune décimale n'est utilisée dans les formules empiriques, vous devrez arrondir chaque valeur au nombre entier le plus proche. 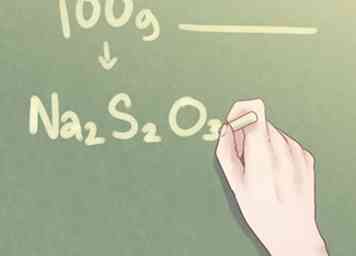 7 Écrivez votre réponse finale. Traduire le ratio d'éléments dans le format standard utilisé pour la formule empirique. La quantité moléculaire de chaque élément doit être indiquée en indice à côté du symbole de son élément respectif pour toutes les quantités supérieures à un.
7 Écrivez votre réponse finale. Traduire le ratio d'éléments dans le format standard utilisé pour la formule empirique. La quantité moléculaire de chaque élément doit être indiquée en indice à côté du symbole de son élément respectif pour toutes les quantités supérieures à un.  1 Considérez le nombre de grammes. Si l'on vous donne la composition élémentaire d'une substance inconnue en grammes, vous devrez procéder selon les instructions suivantes.
1 Considérez le nombre de grammes. Si l'on vous donne la composition élémentaire d'une substance inconnue en grammes, vous devrez procéder selon les instructions suivantes. 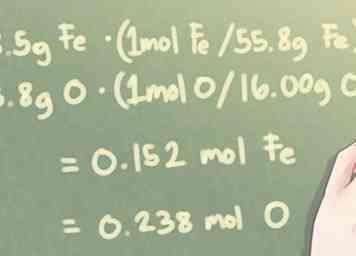 2 Convertir la masse de chaque élément en moles. Pour déterminer le rapport moléculaire des éléments dans le composé, vous devez convertir la quantité de chaque élément de grammes en moles. Faites-le en divisant la masse en grammes pour chaque élément par les poids atomiques respectifs des éléments.
2 Convertir la masse de chaque élément en moles. Pour déterminer le rapport moléculaire des éléments dans le composé, vous devez convertir la quantité de chaque élément de grammes en moles. Faites-le en divisant la masse en grammes pour chaque élément par les poids atomiques respectifs des éléments. 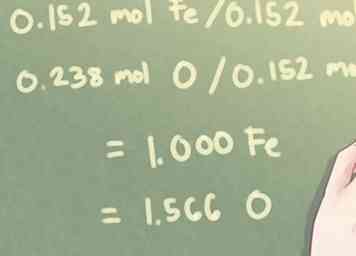 3 Diviser chaque valeur de mole par le plus petit nombre calculé. Déterminez combien de chaque élément est présent par rapport aux autres éléments du composé.Afin de calculer cela, vous devrez identifier le plus petit nombre de taupes présentes et diviser chaque nombre de taupes par ce nombre.
3 Diviser chaque valeur de mole par le plus petit nombre calculé. Déterminez combien de chaque élément est présent par rapport aux autres éléments du composé.Afin de calculer cela, vous devrez identifier le plus petit nombre de taupes présentes et diviser chaque nombre de taupes par ce nombre.  4 Multipliez les valeurs de rapport pour trouver des nombres entiers proches. Souvent, les grains de beauté présents pour chaque substance peuvent ne pas correspondre à un nombre entier. Si l'excédent est à moins d'un dixième, vous pouvez simplement arrondir le tout. Pour les valeurs excédentaires qui dépassent cette valeur, vous devrez toutefois multiplier chaque valeur par un nombre pouvant ramener la valeur du rapport à un nombre entier.
4 Multipliez les valeurs de rapport pour trouver des nombres entiers proches. Souvent, les grains de beauté présents pour chaque substance peuvent ne pas correspondre à un nombre entier. Si l'excédent est à moins d'un dixième, vous pouvez simplement arrondir le tout. Pour les valeurs excédentaires qui dépassent cette valeur, vous devrez toutefois multiplier chaque valeur par un nombre pouvant ramener la valeur du rapport à un nombre entier. 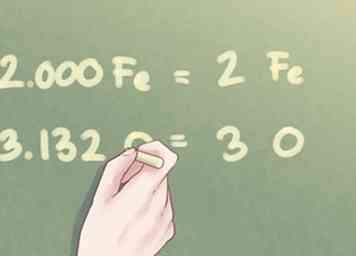 5 Arrondissez votre réponse au nombre entier le plus proche. Une fois que les valeurs de ratio de tous les éléments du composé sont à peu près égales à un dixième de nombre entier, vous pouvez arrondir toute différence au nombre entier le plus proche.
5 Arrondissez votre réponse au nombre entier le plus proche. Une fois que les valeurs de ratio de tous les éléments du composé sont à peu près égales à un dixième de nombre entier, vous pouvez arrondir toute différence au nombre entier le plus proche. 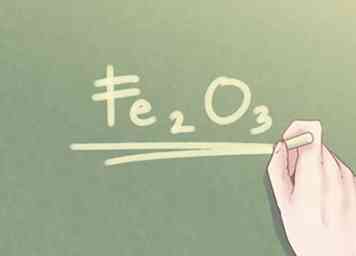 6 Écrivez la réponse finale. Le rapport des éléments doit être réécrit sous forme de formule empirique. Chaque valeur de rapport doit être indiquée en indice à côté du symbole de son élément respectif, sauf si la valeur du rapport est égale à un.
6 Écrivez la réponse finale. Le rapport des éléments doit être réécrit sous forme de formule empirique. Chaque valeur de rapport doit être indiquée en indice à côté du symbole de son élément respectif, sauf si la valeur du rapport est égale à un. 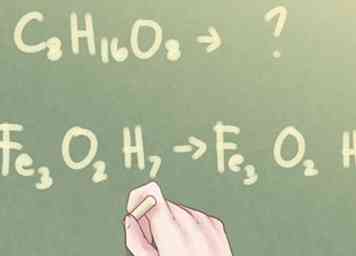 1 Déterminez si les indices peuvent être réduits. Si vous avez la formule moléculaire d'un composé inconnu mais que l'on vous demande d'identifier le composé par sa formule empirique, vous devez déterminer si la formule peut être réduite. Regardez les indices pour chaque élément présent. Si les trois indices partagent au moins un facteur commun (autre que le nombre 1), vous devrez suivre quelques étapes supplémentaires pour déterminer la formule empirique du composé.
1 Déterminez si les indices peuvent être réduits. Si vous avez la formule moléculaire d'un composé inconnu mais que l'on vous demande d'identifier le composé par sa formule empirique, vous devez déterminer si la formule peut être réduite. Regardez les indices pour chaque élément présent. Si les trois indices partagent au moins un facteur commun (autre que le nombre 1), vous devrez suivre quelques étapes supplémentaires pour déterminer la formule empirique du composé.  2 Trouvez le plus grand facteur commun entre les indices. Écrivez les facteurs de chaque indice dans votre formule. Identifiez le facteur qui a la plus grande valeur.
2 Trouvez le plus grand facteur commun entre les indices. Écrivez les facteurs de chaque indice dans votre formule. Identifiez le facteur qui a la plus grande valeur.  3 Divisez chaque indice par le plus grand facteur commun. Pour obtenir chaque indice dans sa forme la plus simple, vous devrez diviser tous les indices présents dans la formule par le GCF que vous venez de trouver.
3 Divisez chaque indice par le plus grand facteur commun. Pour obtenir chaque indice dans sa forme la plus simple, vous devrez diviser tous les indices présents dans la formule par le GCF que vous venez de trouver.  4 Écrivez la réponse finale. Remplacez vos indices d'origine par leurs valeurs simplifiées. Ce faisant, vous avez déterminé la formule empirique du composé à partir de sa formule moléculaire.
4 Écrivez la réponse finale. Remplacez vos indices d'origine par leurs valeurs simplifiées. Ce faisant, vous avez déterminé la formule empirique du composé à partir de sa formule moléculaire.