La densité est définie comme la quantité de masse présente dans un volume donné. Pour les solides et les liquides, il s'agit d'une mesure assez simple. Cependant, les gaz sont extrêmement sensibles à la température et à la pression (plus que les solides ou les liquides), ce qui peut entraîner un changement assez rapide de leurs densités. Si vous déterminez expérimentalement la densité, vous devrez tenir compte de cette sensibilité à la température et à la pression. Si vous avez l'intention de trouver la densité théorique d'un gaz, vous devrez utiliser la loi sur les gaz parfaits pour prendre en compte toutes les variables.
Méthode One of Three:
Détermination de la densité du gaz expérimentalement
-
 1 Remplissez un ballon. Un ballon est conçu pour être gonflé au gaz, ce qui en fait le bateau idéal pour stocker une quantité déterminée de gaz. Vous pouvez remplir le ballon d'air à l'aide d'une pompe ou choisir un autre type de gaz, tel que l'hélium ou l'azote. Une fois que le ballon est rempli, attachez l'extrémité de sorte qu'aucun gaz ne s'échappe.[1]
1 Remplissez un ballon. Un ballon est conçu pour être gonflé au gaz, ce qui en fait le bateau idéal pour stocker une quantité déterminée de gaz. Vous pouvez remplir le ballon d'air à l'aide d'une pompe ou choisir un autre type de gaz, tel que l'hélium ou l'azote. Une fois que le ballon est rempli, attachez l'extrémité de sorte qu'aucun gaz ne s'échappe.[1] -
 2 Immerger le ballon complètement dans un récipient transparent. Ensuite, immergez le ballon dans un contenant d'eau. Le ballon fera monter le niveau d'eau. Marquez la nouvelle hauteur de l'eau et retirez le ballon.[2]
2 Immerger le ballon complètement dans un récipient transparent. Ensuite, immergez le ballon dans un contenant d'eau. Le ballon fera monter le niveau d'eau. Marquez la nouvelle hauteur de l'eau et retirez le ballon.[2] -
 3 Mesurer la quantité d'eau déplacée. Utilisez un instrument de mesure (par exemple une tasse ou un gobelet) pour mesurer la quantité d'eau nécessaire pour remplir le récipient jusqu'à la marque (sans le ballon dans l'eau). Versez lentement. Si vous versez trop, vous devrez recommencer. Le volume du ballon est égal au volume d'eau que vous ajoutez. Enregistrez cette valeur pour une utilisation ultérieure en tant que V.[3]
3 Mesurer la quantité d'eau déplacée. Utilisez un instrument de mesure (par exemple une tasse ou un gobelet) pour mesurer la quantité d'eau nécessaire pour remplir le récipient jusqu'à la marque (sans le ballon dans l'eau). Versez lentement. Si vous versez trop, vous devrez recommencer. Le volume du ballon est égal au volume d'eau que vous ajoutez. Enregistrez cette valeur pour une utilisation ultérieure en tant que V.[3] - Vous pouvez gagner du temps en immergeant le ballon dans un grand bécher ou un autre récipient pré-mesuré. Vous pouvez ensuite sauter l’ajout d’eau et soustraire simplement le volume de l’eau du volume de l’eau et du ballon.
-
 4 Peser le ballon rempli de gaz. Vous pouvez peser le ballon en utilisant une échelle sensible. Les balances électriques sont généralement les meilleures pour cette application. Notez le poids du ballon rempli de gaz pour une utilisation ultérieure comme mGB.[4]
4 Peser le ballon rempli de gaz. Vous pouvez peser le ballon en utilisant une échelle sensible. Les balances électriques sont généralement les meilleures pour cette application. Notez le poids du ballon rempli de gaz pour une utilisation ultérieure comme mGB.[4] - Si vous remplissez le ballon avec un gaz plus léger que l'air, vous devrez peser la prise avant et après avoir rempli le ballon pour déterminer la quantité de gaz utilisée.
-
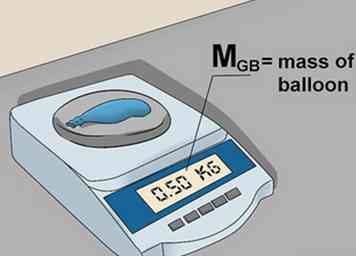 5 Trouvez la masse du ballon vide. Poussez un trou dans le ballon. Cela permettra au gaz de s'échapper. Peser à nouveau le ballon et noter le poids du ballon vide comme mB.[5]
5 Trouvez la masse du ballon vide. Poussez un trou dans le ballon. Cela permettra au gaz de s'échapper. Peser à nouveau le ballon et noter le poids du ballon vide comme mB.[5] -
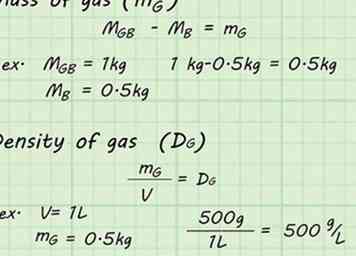 6 Faites les calculs. Maintenant que vous avez suffisamment de données, vous pouvez calculer la densité du gaz à l'intérieur du ballon. Soustraire le poids du ballon vide, mB, du poids du ballon plein, mGB. Cela vous donnera la masse du gaz seul, mg. Diviser la masse du gaz, mg, par le volume, V, du gaz pour trouver la densité du gaz, Dg.[6]
6 Faites les calculs. Maintenant que vous avez suffisamment de données, vous pouvez calculer la densité du gaz à l'intérieur du ballon. Soustraire le poids du ballon vide, mB, du poids du ballon plein, mGB. Cela vous donnera la masse du gaz seul, mg. Diviser la masse du gaz, mg, par le volume, V, du gaz pour trouver la densité du gaz, Dg.[6] - mGB - mB = mg
- Par exemple, si le ballon plein avait une masse de 1 kg et que le ballon vide avait une masse de 0,5 kg, la masse du gaz (mg) serait trouvé par: 1 kg - 0,5 kg = 0,5 kg.
- mg / V = Dg
- Par exemple, si le ballon a déplacé 1 L d'eau, la densité pourrait être obtenue en divisant la masse par ce volume: 500 g / 1 L = 500 g / L
- mGB - mB = mg
Méthode deux sur trois:
Trouver la densité théorique d'un gaz
-
 1 Comprendre la loi des gaz parfaits. Vous devez savoir que la loi sur les gaz parfaits est un outil théorique qui régit le comportement des gaz dans des conditions spécifiques. Vous pouvez le résumer dans l'équation PV = nRT. Cela signifie simplement que la pression (P) multipliée par le volume (V) est égale au nombre de moles (n) multiplié par la constante de gaz idéal (R) multipliée par la température absolue (T) pour un gaz idéal. [7]
1 Comprendre la loi des gaz parfaits. Vous devez savoir que la loi sur les gaz parfaits est un outil théorique qui régit le comportement des gaz dans des conditions spécifiques. Vous pouvez le résumer dans l'équation PV = nRT. Cela signifie simplement que la pression (P) multipliée par le volume (V) est égale au nombre de moles (n) multiplié par la constante de gaz idéal (R) multipliée par la température absolue (T) pour un gaz idéal. [7] - Une mole (n) est égale à 6,022 * 10 ^ 23 molécules de gaz.
- La constante de gaz idéale (R) est de 0,0821 L · atm / mol · K.
- La température absolue est mesurée en Kelvins (K).
-
 2 Assumer la température et la pression standard. La température et la pression standard, ou STP, sont définies sur 273 K (32 ° F) (0 ° C) et 1 atmosphère standard (1,0 bar). En supposant que STP vous permet de calculer le volume de 1 mole de tout gaz à 22,414 litres. Connaître ce volume sera impératif pour trouver la densité de votre gaz.[8]
2 Assumer la température et la pression standard. La température et la pression standard, ou STP, sont définies sur 273 K (32 ° F) (0 ° C) et 1 atmosphère standard (1,0 bar). En supposant que STP vous permet de calculer le volume de 1 mole de tout gaz à 22,414 litres. Connaître ce volume sera impératif pour trouver la densité de votre gaz.[8] -
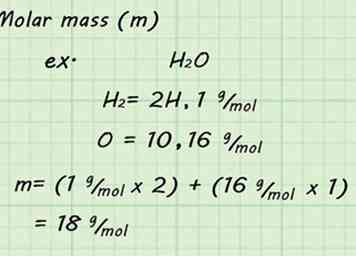 3 Trouvez la masse molaire du gaz. Puisque vous utilisez STP et que vous prenez une mole de gaz, la découverte de la masse molaire sera facile. Ajouter la masse molaire de tous les atomes individuels qui composent votre gaz pour trouver la masse molaire du gaz. Les masses atomiques se trouvent sur le tableau périodique.[9]
3 Trouvez la masse molaire du gaz. Puisque vous utilisez STP et que vous prenez une mole de gaz, la découverte de la masse molaire sera facile. Ajouter la masse molaire de tous les atomes individuels qui composent votre gaz pour trouver la masse molaire du gaz. Les masses atomiques se trouvent sur le tableau périodique.[9] - Par exemple, trouver la masse molaire de H2O gaz signifie ajouter les masses de 2 hydrogènes et 1 oxygène. La masse molaire résultante serait de 18 g / mol (1 g / mol + 1 g / mol + 16 g / mol).
-
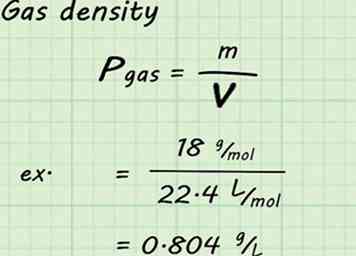 4 Calculez la densité du gaz. Bien que le volume et les moles de gaz soient fixés dans ces calculs, la masse molaire est différente pour chaque gaz. Cela signifie que la densité sera également différente pour chaque gaz. Pour trouver une densité de gaz donnée, divisez la masse molaire du gaz par le volume molaire (22,4 L / mol dans ce cas).[10]
4 Calculez la densité du gaz. Bien que le volume et les moles de gaz soient fixés dans ces calculs, la masse molaire est différente pour chaque gaz. Cela signifie que la densité sera également différente pour chaque gaz. Pour trouver une densité de gaz donnée, divisez la masse molaire du gaz par le volume molaire (22,4 L / mol dans ce cas).[10] - Par exemple, si vous cherchiez la densité de la vapeur d'eau, vous diviseriez 18 g / mol par 22,4 L / mol pour donner 0,804 g / L. C'est-à-dire: 18 g / mol / 22,4 L / mol = 0,804 g / L.
Méthode trois sur trois:
Trouver la densité théorique d'un mélange de gaz
-
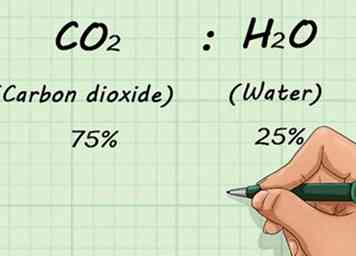 1 Connaître la décomposition fractionnée du mélange de gaz. Si vous avez mélangé deux gaz ou plus, vous devrez savoir quelle quantité de gaz est présente. Cela se fait sur une base de pourcentage. Cela vous permet de connaître les ratios du mélange, quelle que soit la quantité de gaz présente.[11]
1 Connaître la décomposition fractionnée du mélange de gaz. Si vous avez mélangé deux gaz ou plus, vous devrez savoir quelle quantité de gaz est présente. Cela se fait sur une base de pourcentage. Cela vous permet de connaître les ratios du mélange, quelle que soit la quantité de gaz présente.[11] - Par exemple, si vous aviez un mélange de 75% de CO2 (dioxyde de carbone) et 25% H2O (eau), ces ratios ne changeraient pas si vous avez 1 L ou 1 000 L de gaz.
-
 2 Trouvez la masse d'une mole. En connaissant le ratio de vos gaz, vous pouvez trouver la masse molaire de votre mélange. Vous devrez trouver la masse molaire de chaque gaz et la multiplier par sa composition en pourcentage dans le mélange. Ensuite, ajoutez tous les produits ensemble pour trouver la masse molaire du mélange gazeux.[12]
2 Trouvez la masse d'une mole. En connaissant le ratio de vos gaz, vous pouvez trouver la masse molaire de votre mélange. Vous devrez trouver la masse molaire de chaque gaz et la multiplier par sa composition en pourcentage dans le mélange. Ensuite, ajoutez tous les produits ensemble pour trouver la masse molaire du mélange gazeux.[12] - Par exemple, vous trouverez la masse molaire de CO2 (44 g / mol) et le multiplier par 0,75. Ensuite, vous trouverez la masse molaire de H2O (18 g / mol) et multipliez-le par 0,25. Lorsque vous ajoutez ces produits ensemble, 33 g / mol + 4,5 g / mol, vous obtenez la masse molaire de votre mélange. Dans ce cas, la masse molaire est de 37,5 g / mol.
-
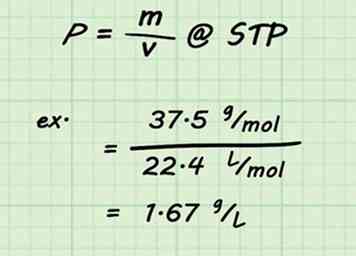 3 Diviser par le volume. Une fois la masse molaire établie pour votre mélange, trouver la densité du gaz est un calcul simple. Diviser la masse molaire par le volume standard (22,4 L / mol). Rappelez-vous que vous prenez STP et 1 mole de gaz.[13]
3 Diviser par le volume. Une fois la masse molaire établie pour votre mélange, trouver la densité du gaz est un calcul simple. Diviser la masse molaire par le volume standard (22,4 L / mol). Rappelez-vous que vous prenez STP et 1 mole de gaz.[13] - Par exemple, la densité d'un mélange de 75% de dioxyde de carbone et de 25% d'eau serait .
- Vous devez appliquer la formule de la loi gaz idéal pour vos calculs si le gaz n'est pas à STP (PV = nRT).
 Minotauromaquia
Minotauromaquia
 1 Remplissez un ballon. Un ballon est conçu pour être gonflé au gaz, ce qui en fait le bateau idéal pour stocker une quantité déterminée de gaz. Vous pouvez remplir le ballon d'air à l'aide d'une pompe ou choisir un autre type de gaz, tel que l'hélium ou l'azote. Une fois que le ballon est rempli, attachez l'extrémité de sorte qu'aucun gaz ne s'échappe.[1]
1 Remplissez un ballon. Un ballon est conçu pour être gonflé au gaz, ce qui en fait le bateau idéal pour stocker une quantité déterminée de gaz. Vous pouvez remplir le ballon d'air à l'aide d'une pompe ou choisir un autre type de gaz, tel que l'hélium ou l'azote. Une fois que le ballon est rempli, attachez l'extrémité de sorte qu'aucun gaz ne s'échappe.[1]  2 Immerger le ballon complètement dans un récipient transparent. Ensuite, immergez le ballon dans un contenant d'eau. Le ballon fera monter le niveau d'eau. Marquez la nouvelle hauteur de l'eau et retirez le ballon.[2]
2 Immerger le ballon complètement dans un récipient transparent. Ensuite, immergez le ballon dans un contenant d'eau. Le ballon fera monter le niveau d'eau. Marquez la nouvelle hauteur de l'eau et retirez le ballon.[2]  3 Mesurer la quantité d'eau déplacée. Utilisez un instrument de mesure (par exemple une tasse ou un gobelet) pour mesurer la quantité d'eau nécessaire pour remplir le récipient jusqu'à la marque (sans le ballon dans l'eau). Versez lentement. Si vous versez trop, vous devrez recommencer. Le volume du ballon est égal au volume d'eau que vous ajoutez. Enregistrez cette valeur pour une utilisation ultérieure en tant que V.[3]
3 Mesurer la quantité d'eau déplacée. Utilisez un instrument de mesure (par exemple une tasse ou un gobelet) pour mesurer la quantité d'eau nécessaire pour remplir le récipient jusqu'à la marque (sans le ballon dans l'eau). Versez lentement. Si vous versez trop, vous devrez recommencer. Le volume du ballon est égal au volume d'eau que vous ajoutez. Enregistrez cette valeur pour une utilisation ultérieure en tant que V.[3]  4 Peser le ballon rempli de gaz. Vous pouvez peser le ballon en utilisant une échelle sensible. Les balances électriques sont généralement les meilleures pour cette application. Notez le poids du ballon rempli de gaz pour une utilisation ultérieure comme mGB.[4]
4 Peser le ballon rempli de gaz. Vous pouvez peser le ballon en utilisant une échelle sensible. Les balances électriques sont généralement les meilleures pour cette application. Notez le poids du ballon rempli de gaz pour une utilisation ultérieure comme mGB.[4]  5 Trouvez la masse du ballon vide. Poussez un trou dans le ballon. Cela permettra au gaz de s'échapper. Peser à nouveau le ballon et noter le poids du ballon vide comme mB.[5]
5 Trouvez la masse du ballon vide. Poussez un trou dans le ballon. Cela permettra au gaz de s'échapper. Peser à nouveau le ballon et noter le poids du ballon vide comme mB.[5] 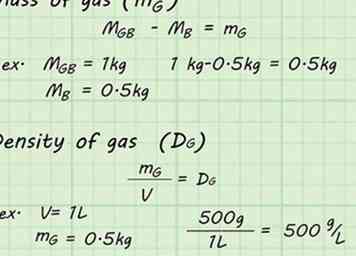 6 Faites les calculs. Maintenant que vous avez suffisamment de données, vous pouvez calculer la densité du gaz à l'intérieur du ballon. Soustraire le poids du ballon vide, mB, du poids du ballon plein, mGB. Cela vous donnera la masse du gaz seul, mg. Diviser la masse du gaz, mg, par le volume, V, du gaz pour trouver la densité du gaz, Dg.[6]
6 Faites les calculs. Maintenant que vous avez suffisamment de données, vous pouvez calculer la densité du gaz à l'intérieur du ballon. Soustraire le poids du ballon vide, mB, du poids du ballon plein, mGB. Cela vous donnera la masse du gaz seul, mg. Diviser la masse du gaz, mg, par le volume, V, du gaz pour trouver la densité du gaz, Dg.[6]  1 Comprendre la loi des gaz parfaits. Vous devez savoir que la loi sur les gaz parfaits est un outil théorique qui régit le comportement des gaz dans des conditions spécifiques. Vous pouvez le résumer dans l'équation PV = nRT. Cela signifie simplement que la pression (P) multipliée par le volume (V) est égale au nombre de moles (n) multiplié par la constante de gaz idéal (R) multipliée par la température absolue (T) pour un gaz idéal. [7]
1 Comprendre la loi des gaz parfaits. Vous devez savoir que la loi sur les gaz parfaits est un outil théorique qui régit le comportement des gaz dans des conditions spécifiques. Vous pouvez le résumer dans l'équation PV = nRT. Cela signifie simplement que la pression (P) multipliée par le volume (V) est égale au nombre de moles (n) multiplié par la constante de gaz idéal (R) multipliée par la température absolue (T) pour un gaz idéal. [7]  2 Assumer la température et la pression standard. La température et la pression standard, ou STP, sont définies sur 273 K (32 ° F) (0 ° C) et 1 atmosphère standard (1,0 bar). En supposant que STP vous permet de calculer le volume de 1 mole de tout gaz à 22,414 litres. Connaître ce volume sera impératif pour trouver la densité de votre gaz.[8]
2 Assumer la température et la pression standard. La température et la pression standard, ou STP, sont définies sur 273 K (32 ° F) (0 ° C) et 1 atmosphère standard (1,0 bar). En supposant que STP vous permet de calculer le volume de 1 mole de tout gaz à 22,414 litres. Connaître ce volume sera impératif pour trouver la densité de votre gaz.[8] 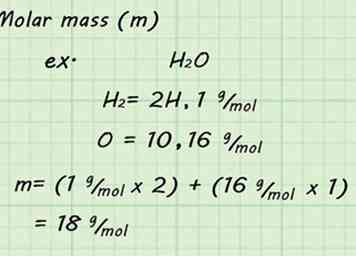 3 Trouvez la masse molaire du gaz. Puisque vous utilisez STP et que vous prenez une mole de gaz, la découverte de la masse molaire sera facile. Ajouter la masse molaire de tous les atomes individuels qui composent votre gaz pour trouver la masse molaire du gaz. Les masses atomiques se trouvent sur le tableau périodique.[9]
3 Trouvez la masse molaire du gaz. Puisque vous utilisez STP et que vous prenez une mole de gaz, la découverte de la masse molaire sera facile. Ajouter la masse molaire de tous les atomes individuels qui composent votre gaz pour trouver la masse molaire du gaz. Les masses atomiques se trouvent sur le tableau périodique.[9] 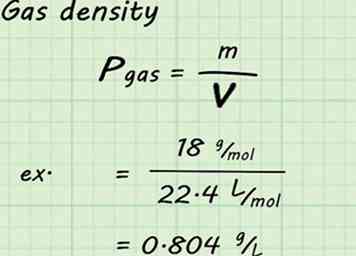 4 Calculez la densité du gaz. Bien que le volume et les moles de gaz soient fixés dans ces calculs, la masse molaire est différente pour chaque gaz. Cela signifie que la densité sera également différente pour chaque gaz. Pour trouver une densité de gaz donnée, divisez la masse molaire du gaz par le volume molaire (22,4 L / mol dans ce cas).[10]
4 Calculez la densité du gaz. Bien que le volume et les moles de gaz soient fixés dans ces calculs, la masse molaire est différente pour chaque gaz. Cela signifie que la densité sera également différente pour chaque gaz. Pour trouver une densité de gaz donnée, divisez la masse molaire du gaz par le volume molaire (22,4 L / mol dans ce cas).[10] 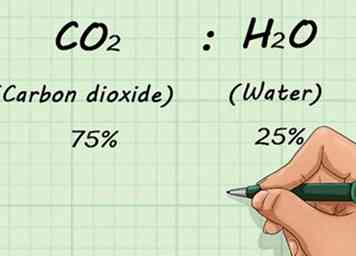 1 Connaître la décomposition fractionnée du mélange de gaz. Si vous avez mélangé deux gaz ou plus, vous devrez savoir quelle quantité de gaz est présente. Cela se fait sur une base de pourcentage. Cela vous permet de connaître les ratios du mélange, quelle que soit la quantité de gaz présente.[11]
1 Connaître la décomposition fractionnée du mélange de gaz. Si vous avez mélangé deux gaz ou plus, vous devrez savoir quelle quantité de gaz est présente. Cela se fait sur une base de pourcentage. Cela vous permet de connaître les ratios du mélange, quelle que soit la quantité de gaz présente.[11]  2 Trouvez la masse d'une mole. En connaissant le ratio de vos gaz, vous pouvez trouver la masse molaire de votre mélange. Vous devrez trouver la masse molaire de chaque gaz et la multiplier par sa composition en pourcentage dans le mélange. Ensuite, ajoutez tous les produits ensemble pour trouver la masse molaire du mélange gazeux.[12]
2 Trouvez la masse d'une mole. En connaissant le ratio de vos gaz, vous pouvez trouver la masse molaire de votre mélange. Vous devrez trouver la masse molaire de chaque gaz et la multiplier par sa composition en pourcentage dans le mélange. Ensuite, ajoutez tous les produits ensemble pour trouver la masse molaire du mélange gazeux.[12] 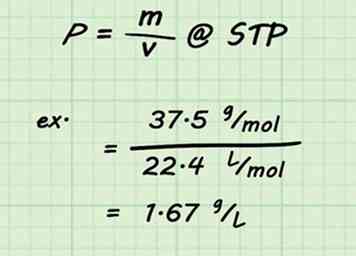 3 Diviser par le volume. Une fois la masse molaire établie pour votre mélange, trouver la densité du gaz est un calcul simple. Diviser la masse molaire par le volume standard (22,4 L / mol). Rappelez-vous que vous prenez STP et 1 mole de gaz.[13]
3 Diviser par le volume. Une fois la masse molaire établie pour votre mélange, trouver la densité du gaz est un calcul simple. Diviser la masse molaire par le volume standard (22,4 L / mol). Rappelez-vous que vous prenez STP et 1 mole de gaz.[13]