Tester le pH de l'eau vous indique à quel point l'eau est basique ou acide au moment du test. L'eau pure et non polluée a normalement un pH de 7, qui est neutre (ni acide ni basique). Le niveau de pH de l'eau peut fournir des informations sur la contamination potentielle et peut constituer une précaution importante pour protéger la santé des personnes, des animaux et de la végétation.
Méthode One of Three:
Utilisation d'un pH-mètre
-
 1 Calibrer la sonde et le compteur conformément aux spécifications du fabricant. Vous devrez peut-être calibrer le lecteur en le testant dans une substance dont le pH est connu. Vous pouvez ensuite ajuster le lecteur en conséquence. Si vous testez de l'eau à partir d'un laboratoire, vous souhaiterez peut-être effectuer cet étalonnage plusieurs heures avant de mettre le lecteur sur le terrain.[1]
1 Calibrer la sonde et le compteur conformément aux spécifications du fabricant. Vous devrez peut-être calibrer le lecteur en le testant dans une substance dont le pH est connu. Vous pouvez ensuite ajuster le lecteur en conséquence. Si vous testez de l'eau à partir d'un laboratoire, vous souhaiterez peut-être effectuer cet étalonnage plusieurs heures avant de mettre le lecteur sur le terrain.[1] - Rincer la sonde avec de l'eau désionisée double avant de l'utiliser. Séchez-le avec un tissu propre.
-
 2 Recueillir un échantillon de l'eau dans un récipient propre. L'échantillon d'eau doit être suffisamment profond pour couvrir l'extrémité de l'électrode. Laissez l'échantillon reposer pendant un moment afin que la température puisse se stabiliser, puis mesurez la température de l'échantillon à l'aide d'un thermomètre.
2 Recueillir un échantillon de l'eau dans un récipient propre. L'échantillon d'eau doit être suffisamment profond pour couvrir l'extrémité de l'électrode. Laissez l'échantillon reposer pendant un moment afin que la température puisse se stabiliser, puis mesurez la température de l'échantillon à l'aide d'un thermomètre. -
 3 Ajustez le compteur pour qu'il corresponde à la température de l'échantillon. La sensibilité de la sonde est affectée par la température de l'eau et la lecture du compteur ne peut donc pas être précise si vous ne saisissez pas les données de température.[2] Le pH de l'eau sera également affecté par la température de l'eau. L'eau pure a un pH inférieur à des températures plus élevées et un pH plus élevé à des températures plus basses.[3]
3 Ajustez le compteur pour qu'il corresponde à la température de l'échantillon. La sensibilité de la sonde est affectée par la température de l'eau et la lecture du compteur ne peut donc pas être précise si vous ne saisissez pas les données de température.[2] Le pH de l'eau sera également affecté par la température de l'eau. L'eau pure a un pH inférieur à des températures plus élevées et un pH plus élevé à des températures plus basses.[3] -
 4 Placez la sonde dans l'échantillon. Attendez que le compteur arrive à l'équilibre. Le compteur a atteint l'équilibre lorsque la mesure est stable.
4 Placez la sonde dans l'échantillon. Attendez que le compteur arrive à l'équilibre. Le compteur a atteint l'équilibre lorsque la mesure est stable. -
 5 Lisez la mesure du pH de l'échantillon. Votre pH-mètre devrait fournir une lecture sur l’échelle de 0 à 14. Si l'eau est pure, elle devrait être proche de 7. Notez vos résultats.
5 Lisez la mesure du pH de l'échantillon. Votre pH-mètre devrait fournir une lecture sur l’échelle de 0 à 14. Si l'eau est pure, elle devrait être proche de 7. Notez vos résultats. - Une valeur de pH inférieure à 7 indique que l'eau est acide, alors qu'une valeur supérieure à 7 indique que l'eau est basique.
Méthode deux sur trois:
Utilisation de papier tournesol
-
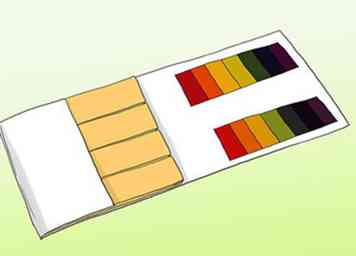 1 Apprenez à connaître la différence entre le papier pH et le papier tournesol. Pour obtenir une lecture précise d'une solution, vous pouvez utiliser du papier pH. Cela ne doit pas être confondu avec le papier de tournesol commun. Les deux peuvent être utilisés pour tester les acides et les bases, mais ils diffèrent de manière importante.[4] Le papier pH vous indiquera la valeur de pH réelle de l'eau, mais les feuilles de tournesol indiquent généralement uniquement si l'eau est basique ou acide.[5]
1 Apprenez à connaître la différence entre le papier pH et le papier tournesol. Pour obtenir une lecture précise d'une solution, vous pouvez utiliser du papier pH. Cela ne doit pas être confondu avec le papier de tournesol commun. Les deux peuvent être utilisés pour tester les acides et les bases, mais ils diffèrent de manière importante.[4] Le papier pH vous indiquera la valeur de pH réelle de l'eau, mais les feuilles de tournesol indiquent généralement uniquement si l'eau est basique ou acide.[5] - Les bandelettes de pH contiennent une série de barres indicatrices qui changeront de couleur après exposition à une solution. La force des acides et des bases sur chaque barre diffère. Après leur modification, le motif de couleur des barres peut correspondre aux exemples fournis avec le kit.
- Les feuilles de tournesol sont des bandes de papier contenant un acide ou une base (alcaline). Les plus communs sont le rouge (qui contient un acide qui réagit avec les bases) et le bleu (qui contient une base qui réagit avec les acides). Les bandes rouges deviennent bleues si la substance est alcaline et les bandes bleues deviennent rouges si elles entrent en contact avec un acide. Les papiers de tournesol peuvent être utilisés pour effectuer un test rapide et facile, mais leur prix le plus bas ne permet pas toujours des lectures précises de la force de la solution.
-
 2 Recueillir un échantillon de l'eau dans un récipient propre. L'échantillon d'eau doit être suffisamment profond pour recouvrir la bandelette de test.
2 Recueillir un échantillon de l'eau dans un récipient propre. L'échantillon d'eau doit être suffisamment profond pour recouvrir la bandelette de test. -
 3 Trempez une bandelette de test dans votre échantillon. Quelques secondes d'exposition suffisent. Les différentes barres indicatrices sur le papier vont commencer à changer de couleur en quelques instants.
3 Trempez une bandelette de test dans votre échantillon. Quelques secondes d'exposition suffisent. Les différentes barres indicatrices sur le papier vont commencer à changer de couleur en quelques instants. -
 4 Comparez la bandelette de test avec le nuancier fourni avec le papier. La couleur du graphique doit correspondre à la couleur de votre bandelette. Le graphique devrait corréler les couleurs aux niveaux de pH.
4 Comparez la bandelette de test avec le nuancier fourni avec le papier. La couleur du graphique doit correspondre à la couleur de votre bandelette. Le graphique devrait corréler les couleurs aux niveaux de pH.
Méthode trois sur trois:
Comprendre le pH
-
 1 Découvrez comment les acides et les bases sont définis. L'acidité et l'alcalinité (le terme utilisé pour décrire les bases) sont toutes deux définies par les ions hydrogène qu'elles perdent ou acceptent. Un acide est une substance qui perd (ou, selon certains, donne) des ions hydrogène. Une base est une substance qui accepte des ions hydrogène supplémentaires.
1 Découvrez comment les acides et les bases sont définis. L'acidité et l'alcalinité (le terme utilisé pour décrire les bases) sont toutes deux définies par les ions hydrogène qu'elles perdent ou acceptent. Un acide est une substance qui perd (ou, selon certains, donne) des ions hydrogène. Une base est une substance qui accepte des ions hydrogène supplémentaires. -
 2 Familiarisez-vous avec l'échelle de pH. Le numéro de pH est utilisé pour évaluer le niveau d'acidité ou d'alcalinité des substances solubles dans l'eau. L'eau contient normalement une quantité égale d'ions hydroxyde (OH-) et d'ions hydronium (H30 +). Lorsqu'une substance acide ou alcaline est ajoutée à l'eau, elle modifie la proportion d'ions hydroxyde et hydronium.[6]
2 Familiarisez-vous avec l'échelle de pH. Le numéro de pH est utilisé pour évaluer le niveau d'acidité ou d'alcalinité des substances solubles dans l'eau. L'eau contient normalement une quantité égale d'ions hydroxyde (OH-) et d'ions hydronium (H30 +). Lorsqu'une substance acide ou alcaline est ajoutée à l'eau, elle modifie la proportion d'ions hydroxyde et hydronium.[6] - Le pH est généralement mesuré sur une échelle de 0 à 14 (bien que les substances puissent réellement tomber au-delà de cet intervalle). Les substances neutres se situent près de 7, les acides en dessous de 7 et les substances alcalines sont supérieures à 7.
- L'échelle de pH est une échelle logarithmique, ce qui signifie que les différences d'un entier unique représentent en réalité une différence de dix dans l'acidité ou l'alcalinité. Par exemple, une substance qui a un pH de 2 est en réalité 10 fois plus acide que celle ayant un pH de 3 et 100 fois plus acide qu'une substance ayant un pH de 4. L'échelle fonctionne de la même manière pour les substances alcalines, avec 1 entier représentant une dixième différence d'alcalinité.
-
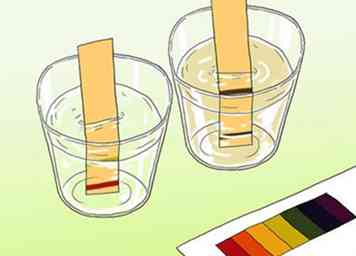 3 Apprenez à savoir pourquoi nous testons le pH de l'eau. L'eau pure doit avoir un pH de 7, bien que l'eau du robinet ait un pH compris entre 6 et 5,5. Une eau très acide (eau à faible pH) est plus susceptible de dissoudre les produits chimiques toxiques. Celles-ci peuvent contaminer l'eau et la rendre dangereuse pour la consommation humaine.[7]
3 Apprenez à savoir pourquoi nous testons le pH de l'eau. L'eau pure doit avoir un pH de 7, bien que l'eau du robinet ait un pH compris entre 6 et 5,5. Une eau très acide (eau à faible pH) est plus susceptible de dissoudre les produits chimiques toxiques. Celles-ci peuvent contaminer l'eau et la rendre dangereuse pour la consommation humaine.[7] - Il est souvent considéré préférable de tester le pH sur site. Si vous collectez un échantillon d'eau pour étude dans un laboratoire, le dioxyde de carbone présent dans l'air peut se dissoudre dans l'eau. Le dioxyde de carbone dissous réagit avec les ions dans l'eau pour augmenter l'acidité dans les solutions basiques ou neutres. Pour prévenir la contamination par le dioxyde de carbone, vous devez tester l'eau dans les 2 heures suivant le prélèvement.[8]
 Minotauromaquia
Minotauromaquia
 1 Calibrer la sonde et le compteur conformément aux spécifications du fabricant. Vous devrez peut-être calibrer le lecteur en le testant dans une substance dont le pH est connu. Vous pouvez ensuite ajuster le lecteur en conséquence. Si vous testez de l'eau à partir d'un laboratoire, vous souhaiterez peut-être effectuer cet étalonnage plusieurs heures avant de mettre le lecteur sur le terrain.[1]
1 Calibrer la sonde et le compteur conformément aux spécifications du fabricant. Vous devrez peut-être calibrer le lecteur en le testant dans une substance dont le pH est connu. Vous pouvez ensuite ajuster le lecteur en conséquence. Si vous testez de l'eau à partir d'un laboratoire, vous souhaiterez peut-être effectuer cet étalonnage plusieurs heures avant de mettre le lecteur sur le terrain.[1]  2 Recueillir un échantillon de l'eau dans un récipient propre. L'échantillon d'eau doit être suffisamment profond pour couvrir l'extrémité de l'électrode. Laissez l'échantillon reposer pendant un moment afin que la température puisse se stabiliser, puis mesurez la température de l'échantillon à l'aide d'un thermomètre.
2 Recueillir un échantillon de l'eau dans un récipient propre. L'échantillon d'eau doit être suffisamment profond pour couvrir l'extrémité de l'électrode. Laissez l'échantillon reposer pendant un moment afin que la température puisse se stabiliser, puis mesurez la température de l'échantillon à l'aide d'un thermomètre.  3 Ajustez le compteur pour qu'il corresponde à la température de l'échantillon. La sensibilité de la sonde est affectée par la température de l'eau et la lecture du compteur ne peut donc pas être précise si vous ne saisissez pas les données de température.[2] Le pH de l'eau sera également affecté par la température de l'eau. L'eau pure a un pH inférieur à des températures plus élevées et un pH plus élevé à des températures plus basses.[3]
3 Ajustez le compteur pour qu'il corresponde à la température de l'échantillon. La sensibilité de la sonde est affectée par la température de l'eau et la lecture du compteur ne peut donc pas être précise si vous ne saisissez pas les données de température.[2] Le pH de l'eau sera également affecté par la température de l'eau. L'eau pure a un pH inférieur à des températures plus élevées et un pH plus élevé à des températures plus basses.[3]  4 Placez la sonde dans l'échantillon. Attendez que le compteur arrive à l'équilibre. Le compteur a atteint l'équilibre lorsque la mesure est stable.
4 Placez la sonde dans l'échantillon. Attendez que le compteur arrive à l'équilibre. Le compteur a atteint l'équilibre lorsque la mesure est stable.  5 Lisez la mesure du pH de l'échantillon. Votre pH-mètre devrait fournir une lecture sur l’échelle de 0 à 14. Si l'eau est pure, elle devrait être proche de 7. Notez vos résultats.
5 Lisez la mesure du pH de l'échantillon. Votre pH-mètre devrait fournir une lecture sur l’échelle de 0 à 14. Si l'eau est pure, elle devrait être proche de 7. Notez vos résultats.  1 Apprenez à connaître la différence entre le papier pH et le papier tournesol. Pour obtenir une lecture précise d'une solution, vous pouvez utiliser du papier pH. Cela ne doit pas être confondu avec le papier de tournesol commun. Les deux peuvent être utilisés pour tester les acides et les bases, mais ils diffèrent de manière importante.[4] Le papier pH vous indiquera la valeur de pH réelle de l'eau, mais les feuilles de tournesol indiquent généralement uniquement si l'eau est basique ou acide.[5]
1 Apprenez à connaître la différence entre le papier pH et le papier tournesol. Pour obtenir une lecture précise d'une solution, vous pouvez utiliser du papier pH. Cela ne doit pas être confondu avec le papier de tournesol commun. Les deux peuvent être utilisés pour tester les acides et les bases, mais ils diffèrent de manière importante.[4] Le papier pH vous indiquera la valeur de pH réelle de l'eau, mais les feuilles de tournesol indiquent généralement uniquement si l'eau est basique ou acide.[5]  2 Recueillir un échantillon de l'eau dans un récipient propre. L'échantillon d'eau doit être suffisamment profond pour recouvrir la bandelette de test.
2 Recueillir un échantillon de l'eau dans un récipient propre. L'échantillon d'eau doit être suffisamment profond pour recouvrir la bandelette de test.  3 Trempez une bandelette de test dans votre échantillon. Quelques secondes d'exposition suffisent. Les différentes barres indicatrices sur le papier vont commencer à changer de couleur en quelques instants.
3 Trempez une bandelette de test dans votre échantillon. Quelques secondes d'exposition suffisent. Les différentes barres indicatrices sur le papier vont commencer à changer de couleur en quelques instants.  4 Comparez la bandelette de test avec le nuancier fourni avec le papier. La couleur du graphique doit correspondre à la couleur de votre bandelette. Le graphique devrait corréler les couleurs aux niveaux de pH.
4 Comparez la bandelette de test avec le nuancier fourni avec le papier. La couleur du graphique doit correspondre à la couleur de votre bandelette. Le graphique devrait corréler les couleurs aux niveaux de pH.  1 Découvrez comment les acides et les bases sont définis. L'acidité et l'alcalinité (le terme utilisé pour décrire les bases) sont toutes deux définies par les ions hydrogène qu'elles perdent ou acceptent. Un acide est une substance qui perd (ou, selon certains, donne) des ions hydrogène. Une base est une substance qui accepte des ions hydrogène supplémentaires.
1 Découvrez comment les acides et les bases sont définis. L'acidité et l'alcalinité (le terme utilisé pour décrire les bases) sont toutes deux définies par les ions hydrogène qu'elles perdent ou acceptent. Un acide est une substance qui perd (ou, selon certains, donne) des ions hydrogène. Une base est une substance qui accepte des ions hydrogène supplémentaires.  2 Familiarisez-vous avec l'échelle de pH. Le numéro de pH est utilisé pour évaluer le niveau d'acidité ou d'alcalinité des substances solubles dans l'eau. L'eau contient normalement une quantité égale d'ions hydroxyde (OH-) et d'ions hydronium (H30 +). Lorsqu'une substance acide ou alcaline est ajoutée à l'eau, elle modifie la proportion d'ions hydroxyde et hydronium.[6]
2 Familiarisez-vous avec l'échelle de pH. Le numéro de pH est utilisé pour évaluer le niveau d'acidité ou d'alcalinité des substances solubles dans l'eau. L'eau contient normalement une quantité égale d'ions hydroxyde (OH-) et d'ions hydronium (H30 +). Lorsqu'une substance acide ou alcaline est ajoutée à l'eau, elle modifie la proportion d'ions hydroxyde et hydronium.[6]  3 Apprenez à savoir pourquoi nous testons le pH de l'eau. L'eau pure doit avoir un pH de 7, bien que l'eau du robinet ait un pH compris entre 6 et 5,5. Une eau très acide (eau à faible pH) est plus susceptible de dissoudre les produits chimiques toxiques. Celles-ci peuvent contaminer l'eau et la rendre dangereuse pour la consommation humaine.[7]
3 Apprenez à savoir pourquoi nous testons le pH de l'eau. L'eau pure doit avoir un pH de 7, bien que l'eau du robinet ait un pH compris entre 6 et 5,5. Une eau très acide (eau à faible pH) est plus susceptible de dissoudre les produits chimiques toxiques. Celles-ci peuvent contaminer l'eau et la rendre dangereuse pour la consommation humaine.[7]