Nommer des composés chimiques de base est essentiel si vous voulez réussir en chimie, puisque le nom du composé définit clairement ce que c'est. Chaque type de composé a ses propres règles pour le nommer. Lorsque vous nommez des composés, vous devez comprendre ces différentes règles, ainsi que la manière de repérer les indices qui vous aideront à nommer correctement les composés. Suivez ce guide pour connaître les règles de base sur la manière dont les composés chimiques ont leur nom et comment appliquer des noms aux composés avec lesquels vous n'êtes pas familier.
Méthode One of Three:
Nommer des composés ioniques
-
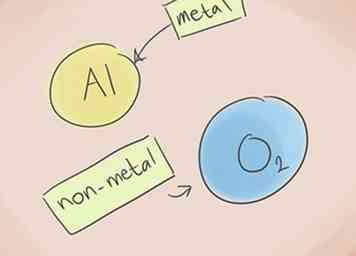 1 Savoir ce qui fait un composé ionique. Les composés ioniques contiennent un métal et un non-métal. Reportez-vous au tableau périodique des éléments pour voir à quelles catégories appartiennent les éléments du composé.[1]
1 Savoir ce qui fait un composé ionique. Les composés ioniques contiennent un métal et un non-métal. Reportez-vous au tableau périodique des éléments pour voir à quelles catégories appartiennent les éléments du composé.[1] -
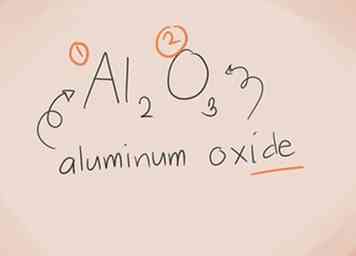 2 Construisez le nom. Pour un composé ionique à deux éléments, la dénomination est simple. La première partie du nom est le nom de l'élément métallique. La deuxième partie est le nom de l'élément non métallique, avec le suffixe «-ide».[2]
2 Construisez le nom. Pour un composé ionique à deux éléments, la dénomination est simple. La première partie du nom est le nom de l'élément métallique. La deuxième partie est le nom de l'élément non métallique, avec le suffixe «-ide».[2] - Voici quelques exemples:
- Al2O3. Al2 = Aluminium O3 = Oxygène. Donc, le nom serait «oxyde d'aluminium».
- FeCl3. Fe = Fer; Cl3 = Chlore. Donc, le nom serait "chlorure de fer".
- SnO2. Sn = étain; O2 = Oxygène. Ainsi, le nom de ce composé serait l'oxyde d'étain.
- Voici quelques exemples:
-
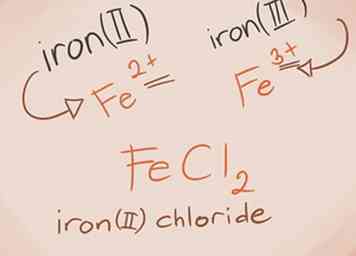 3 Reconnaître et nommer les métaux de transition. Les métaux dans les blocs D et F du tableau périodique sont appelés métaux de transition. Leur charge est écrite avec un chiffre romain lors de l’écriture du nom composé. C'est parce qu'ils peuvent avoir plus d'une charge et faire plus d'un composé.[3]
3 Reconnaître et nommer les métaux de transition. Les métaux dans les blocs D et F du tableau périodique sont appelés métaux de transition. Leur charge est écrite avec un chiffre romain lors de l’écriture du nom composé. C'est parce qu'ils peuvent avoir plus d'une charge et faire plus d'un composé.[3] - Exemple: FeCl2 et FeCl3. Fe = Fer; Cl2 = Chlorure -2; Cl3 = Chlorure -3. Les noms seraient le chlorure de fer (II) et le chlorure de fer (III).
Méthode deux sur trois:
Nommer les composés polyatomiques
-
 1 Comprendre ce qu'est un composé polyatomique. Ces composés sont constitués de groupes d'atomes liés par covalence et le groupe entier a une charge positive ou négative.[4] Vous pouvez faire trois choses de base aux composés polyatomiques, qui vous aideront à identifier et à comprendre ces types de composés:
1 Comprendre ce qu'est un composé polyatomique. Ces composés sont constitués de groupes d'atomes liés par covalence et le groupe entier a une charge positive ou négative.[4] Vous pouvez faire trois choses de base aux composés polyatomiques, qui vous aideront à identifier et à comprendre ces types de composés: - Ajouter un hydrogène au début du composé. Le mot «hydrogène» est ajouté au début du nom composé. Cela réduit la charge négative de un. Par exemple, «carbonate» CO32- devient «hydrogénocarbonate» HCO3-.

- Retirer un oxygène du composé. La charge reste la même et la fin du composé passe de «-ate» à «-ite». Par exemple: NON3 à NON2 passe de «nitrate» à «nitrite».

- Remplacez l'atome central par un autre du même groupe périodique. Par exemple, le sulfate SO42- peut devenir Selenate SeO42-.
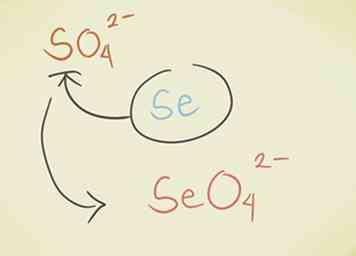
- Ajouter un hydrogène au début du composé. Le mot «hydrogène» est ajouté au début du nom composé. Cela réduit la charge négative de un. Par exemple, «carbonate» CO32- devient «hydrogénocarbonate» HCO3-.
-
 2 Mémorisez les groupes d'ions les plus courants. Celles-ci sont la base pour former la plupart des composés polyatomiques. Répertoriés par ordre croissant de charge négative, ils sont:
2 Mémorisez les groupes d'ions les plus courants. Celles-ci sont la base pour former la plupart des composés polyatomiques. Répertoriés par ordre croissant de charge négative, ils sont: - Ion hydroxyde: OH-
- Ion nitrate: non3-
- Ion carbonate d'hydrogène: HCO3-
- Ion permanganate: MnO4-
- Ion carbonate: CO32-
- Chromate ion: CrO42-
- Dichromate ion: Cr2O72-
- Sulfate ion: SO42-
- Ion sulfite: SO32-
- Ion thiosulfate: S2O3<2-
- Ion phosphate: PO43-
- Ion ammonium: NH4+
- 3 Construire des noms composés en dehors de la liste. Associez le ou les éléments attachés au groupe et nommez-le en conséquence. Si l'élément se trouve devant le groupe d'ions, le nom de l'élément est simplement ajouté au début du nom composé.
- Exemple: KMnO4. Vous devriez reconnaître le MnO4- ion sous forme de permanganate. K est le potassium, donc le composé est appelé permanganate de potassium.

- Exemple: NaOH. Vous devriez reconnaître le OH- ion sous forme d'hydroxyde. Na est le sodium, donc le composé est appelé hydroxyde de sodium.
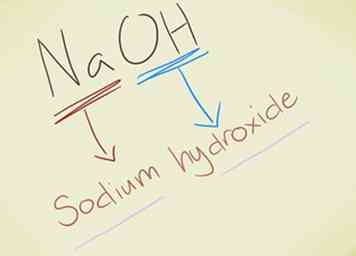
- Exemple: KMnO4. Vous devriez reconnaître le MnO4- ion sous forme de permanganate. K est le potassium, donc le composé est appelé permanganate de potassium.
Méthode trois sur trois:
Nommage des composés covalents
-
 1 Comprendre un composé covalent. Les composés covalents sont formés par deux ou plusieurs éléments non métalliques. Le nom du composé est basé sur le nombre d'atomes présents. Le préfixe attaché est le terme latin pour le nombre de molécules.
1 Comprendre un composé covalent. Les composés covalents sont formés par deux ou plusieurs éléments non métalliques. Le nom du composé est basé sur le nombre d'atomes présents. Le préfixe attaché est le terme latin pour le nombre de molécules. -
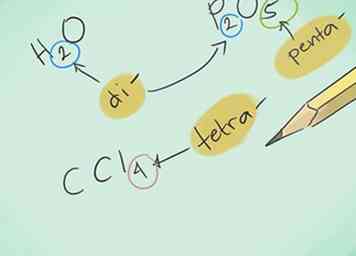 2 Apprenez les préfixes. Mémorisez les préfixes pour 10 atomes au maximum:
2 Apprenez les préfixes. Mémorisez les préfixes pour 10 atomes au maximum: - 1 atome - “Mono-“
- 2 atomes - “Di-“
- 3 atomes - “Tri-“
- 4 atomes - "Tetra-"
- 5 atomes - “Penta-”
- 6 atomes - “Hexa-“
- 7 atomes - "Hepta-"
- 8 atomes - “Octa-“
- 9 atomes - “Nona-“
- 10 atomes - “Deca-“
- 3 Nommez les composés. En utilisant les préfixes corrects, nommez le nouveau composé. Vous attachez des préfixes à n'importe quelle partie du composé qui a plusieurs atomes.
- Exemple: CO serait du monoxyde de carbone et du CO2 serait le dioxyde de carbone.

- Exemple: N2S3 serait le trisulfure d'azote.
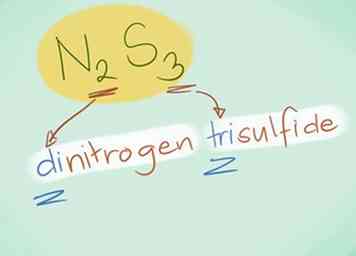
- Dans la plupart des cas, le préfixe «mono-» peut être omis, car il est implicite lorsqu'il n'est pas présent. Il est encore utilisé pour le monoxyde de carbone en raison du terme utilisé depuis les débuts de la chimie.

- Exemple: CO serait du monoxyde de carbone et du CO2 serait le dioxyde de carbone.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Savoir ce qui fait un composé ionique. Les composés ioniques contiennent un métal et un non-métal. Reportez-vous au tableau périodique des éléments pour voir à quelles catégories appartiennent les éléments du composé.[1]
1 Savoir ce qui fait un composé ionique. Les composés ioniques contiennent un métal et un non-métal. Reportez-vous au tableau périodique des éléments pour voir à quelles catégories appartiennent les éléments du composé.[1] 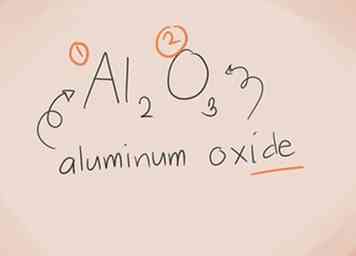 2 Construisez le nom. Pour un composé ionique à deux éléments, la dénomination est simple. La première partie du nom est le nom de l'élément métallique. La deuxième partie est le nom de l'élément non métallique, avec le suffixe «-ide».[2]
2 Construisez le nom. Pour un composé ionique à deux éléments, la dénomination est simple. La première partie du nom est le nom de l'élément métallique. La deuxième partie est le nom de l'élément non métallique, avec le suffixe «-ide».[2] 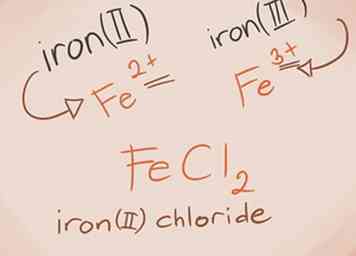 3 Reconnaître et nommer les métaux de transition. Les métaux dans les blocs D et F du tableau périodique sont appelés métaux de transition. Leur charge est écrite avec un chiffre romain lors de l’écriture du nom composé. C'est parce qu'ils peuvent avoir plus d'une charge et faire plus d'un composé.[3]
3 Reconnaître et nommer les métaux de transition. Les métaux dans les blocs D et F du tableau périodique sont appelés métaux de transition. Leur charge est écrite avec un chiffre romain lors de l’écriture du nom composé. C'est parce qu'ils peuvent avoir plus d'une charge et faire plus d'un composé.[3]  1 Comprendre ce qu'est un composé polyatomique. Ces composés sont constitués de groupes d'atomes liés par covalence et le groupe entier a une charge positive ou négative.[4] Vous pouvez faire trois choses de base aux composés polyatomiques, qui vous aideront à identifier et à comprendre ces types de composés:
1 Comprendre ce qu'est un composé polyatomique. Ces composés sont constitués de groupes d'atomes liés par covalence et le groupe entier a une charge positive ou négative.[4] Vous pouvez faire trois choses de base aux composés polyatomiques, qui vous aideront à identifier et à comprendre ces types de composés: 


 2 Mémorisez les groupes d'ions les plus courants. Celles-ci sont la base pour former la plupart des composés polyatomiques. Répertoriés par ordre croissant de charge négative, ils sont:
2 Mémorisez les groupes d'ions les plus courants. Celles-ci sont la base pour former la plupart des composés polyatomiques. Répertoriés par ordre croissant de charge négative, ils sont: 

 1 Comprendre un composé covalent. Les composés covalents sont formés par deux ou plusieurs éléments non métalliques. Le nom du composé est basé sur le nombre d'atomes présents. Le préfixe attaché est le terme latin pour le nombre de molécules.
1 Comprendre un composé covalent. Les composés covalents sont formés par deux ou plusieurs éléments non métalliques. Le nom du composé est basé sur le nombre d'atomes présents. Le préfixe attaché est le terme latin pour le nombre de molécules.  2 Apprenez les préfixes. Mémorisez les préfixes pour 10 atomes au maximum:
2 Apprenez les préfixes. Mémorisez les préfixes pour 10 atomes au maximum: 

