En chimie, une molécule est covalente quand il est formé de liens entre non-métaux.[1] Nommer ces types de composés consiste généralement à connaître les noms des atomes dans la molécule, ainsi que le nombre de chaque atome. Certaines règles spéciales existent pour les acides et les composés apparentés, qui sont généralement reconnus par la présence d'un ou de plusieurs atomes d'hydrogène au début de la formule du composé.
Méthode One of Three:
Apprentissage des préfixes numériques pour les composés covalents
| Nombre | Préfixe grec | Exemple |
|---|---|---|
| 1 | Mono- | Carbone monoxide (CO) |
| 2 | Di- | Carbone dioxyde (CO2) |
| 3 | Tri- | Phosphoreux trihydrure (PH3) |
| 4 | Tetra- | Silicium tetrafluorure (SiF4) |
| 5 | Penta- | L'azote pentoxyde (N2O5) |
| 6 | Hexa- | Soufre hexachlorure (SCl6) |
| 7 | Hepta- | Iode heptafluorure (IF7) |
| 8 | Octa- | Tetranitrogen octachlorure (N4Cl8) |
Méthode deux sur trois:
Nommer des composés binaires de base
-
 1 Nommez le premier élément du composé. Les formules moléculaires se lisent de gauche à droite, tout comme les mots anglais. Généralement, le premier atome (le 1 à gauche de la formule moléculaire) est également l'atome le moins abondant du composé. Ecrivez le nom de cet atome en premier.
1 Nommez le premier élément du composé. Les formules moléculaires se lisent de gauche à droite, tout comme les mots anglais. Généralement, le premier atome (le 1 à gauche de la formule moléculaire) est également l'atome le moins abondant du composé. Ecrivez le nom de cet atome en premier. - Par exemple, dans la formule moléculaire CF4, Le carbone (C) vient en premier, donc nous l'écrivons d'abord: "Carbone"
- Si vous ne connaissez que les atomes de la molécule et que vous ne connaissez pas la formule moléculaire, ne vous inquiétez pas. Dans les composés covalents, l'élément qui vient en premier dans cette liste est inscrit en premier dans la formule moléculaire:[3]
-
- B, Si, C, Sb, As, P, N, H, Te, Se, S, I, Br, Cl, O, F
-
- Notez qu'il y a une exception: lorsque l'oxygène est associé à un halogène (un élément de période 7 comme F, Cl, etc.), l'halogène vient en premier, comme dans le monoxyde de chlore, qui est écrit comme ClO.[4]
-
 2 Écrivez le préfixe grec pour le numéro du deuxième atome. Ensuite, regardez le deuxième atome de la molécule. Détermine combien de fois il apparaît dans la molécule. C'est le nombre écrit en indice à côté dans la formule moléculaire. S'il n'y a pas de numéro à côté du deuxième atome, il apparaît une fois. Trouvez le préfixe grec approprié dans le tableau ci-dessus et écrivez-le ensuite.
2 Écrivez le préfixe grec pour le numéro du deuxième atome. Ensuite, regardez le deuxième atome de la molécule. Détermine combien de fois il apparaît dans la molécule. C'est le nombre écrit en indice à côté dans la formule moléculaire. S'il n'y a pas de numéro à côté du deuxième atome, il apparaît une fois. Trouvez le préfixe grec approprié dans le tableau ci-dessus et écrivez-le ensuite. - Dans notre élément échantillon, CF4le fluor est le deuxième élément et apparaît quatre fois. Nous allons écrire le préfixe grec pour quatre, tetra, ensuite, comme ceci: "Tétra de carbone"
-
 3 Nommez le deuxième atome et terminez-le avec "-ide." Maintenant, écrivez simplement le nom du deuxième atome comme s'il s'agissait d'un anion (ion chargé négativement). En d'autres termes, il suffit de coller "-ide" à la fin. Dans la plupart des cas, vous devrez laisser tomber une lettre ou 2 à la fin du nom, mais ceci est plus naturel au fur et à mesure que vous le faites. Par exemple, l'oxygène devient "oxyde", le chlore devient "chlorure", etc.[5]
3 Nommez le deuxième atome et terminez-le avec "-ide." Maintenant, écrivez simplement le nom du deuxième atome comme s'il s'agissait d'un anion (ion chargé négativement). En d'autres termes, il suffit de coller "-ide" à la fin. Dans la plupart des cas, vous devrez laisser tomber une lettre ou 2 à la fin du nom, mais ceci est plus naturel au fur et à mesure que vous le faites. Par exemple, l'oxygène devient "oxyde", le chlore devient "chlorure", etc.[5] - Dans notre élément échantillon, CF4le fluor est le deuxième élément, nous allons donc l'écrire à la fin. Veillez à ajouter la fin de -ide, comme ceci: "Tétrafluorure de carbone".
- Notez que le préfixe grec et le deuxième atome forment un seul mot ensemble. Ils ne sont jamais écrits comme 2 mots séparés.
-
 4 Ajoutez un préfixe grec au début s'il y en a plus d'un. Déterminez combien de fois le premier atome apparaît dans la molécule. Si vous avez la formule moléculaire, ce sera le nombre écrit en indice après le premier atome. Encore une fois, s'il n'y a pas de numéro, le premier atome apparaît une fois. Si l'atome Est-ce que apparaissent plus d'une fois, écrivez son préfixe grec au début du nom.
4 Ajoutez un préfixe grec au début s'il y en a plus d'un. Déterminez combien de fois le premier atome apparaît dans la molécule. Si vous avez la formule moléculaire, ce sera le nombre écrit en indice après le premier atome. Encore une fois, s'il n'y a pas de numéro, le premier atome apparaît une fois. Si l'atome Est-ce que apparaissent plus d'une fois, écrivez son préfixe grec au début du nom. - Dans notre élément échantillon, CF4Le carbone apparaît une fois, nous n'avons donc rien à faire. Nous n'écririons pas "mono" au début. Vous n'utilisez que "mono" pour le deuxième atome - jamais le premier. Par exemple, tétrachlorure de diazote serait écrit comme N2F4.
-
 5 Mets le tout ensemble. Félicitations - vous avez terminé. Le nom de votre composé est écrit sous cette forme:
5 Mets le tout ensemble. Félicitations - vous avez terminé. Le nom de votre composé est écrit sous cette forme: - [Préfixe (s'il y en a plusieurs)] [Atome 1] suivi de [Préfixe] [Atome 2 "-"
- Nous connaissons déjà le nom de notre composé: Tétrafluorure de carbone.
-
 6 Sachez que certains composés sont des exceptions aux règles de nommage normales. Les règles ci-dessus vous seront utiles pour presque toutes les molécules covalentes binaires normales. Cependant, quelques molécules sélectionnées obtiennent des noms spéciaux qui sont presque toujours utilisés quand ils sont discutés dans des paramètres scientifiques. Il n'y a pas vraiment moyen de les prédire - il suffit de les apprendre. Quelques exemples incluent:[6]
6 Sachez que certains composés sont des exceptions aux règles de nommage normales. Les règles ci-dessus vous seront utiles pour presque toutes les molécules covalentes binaires normales. Cependant, quelques molécules sélectionnées obtiennent des noms spéciaux qui sont presque toujours utilisés quand ils sont discutés dans des paramètres scientifiques. Il n'y a pas vraiment moyen de les prédire - il suffit de les apprendre. Quelques exemples incluent:[6] - H2O n'est pas l'oxyde de dihydrogène. Ses "eau."
- NH3 n'est pas du trihydrure d'azote. Ses "ammoniac."
- CH4 n'est pas du tétrahydrure de carbone. Ses "méthane."
Méthode trois sur trois:
Nommer les acides et les oxyacides
-
 1 Vérifiez si l'acide contient un oxygène. Les acides sont des composés qui donnent des protons à des réactions chimiques. Souvent, les acides commencent avec un ou plusieurs atomes d’H, bien qu’il y ait des exceptions.[7] La première étape pour nommer un acide est simple: commencez par voir rapidement s'il y a de l'oxygène (O).
1 Vérifiez si l'acide contient un oxygène. Les acides sont des composés qui donnent des protons à des réactions chimiques. Souvent, les acides commencent avec un ou plusieurs atomes d’H, bien qu’il y ait des exceptions.[7] La première étape pour nommer un acide est simple: commencez par voir rapidement s'il y a de l'oxygène (O). - Par exemple, disons que nous travaillons avec le HCl acide. Cela évidemment ne pas avoir de l'oxygène dedans.
-
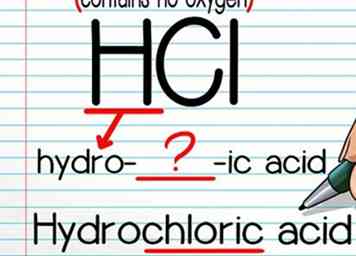 2 Utilisez la formule "acide hydro- (acide)" s'il n'y a pas d'atome d'oxygène. Nommer des acides sans atome d'oxygène est facile. D'abord, écrivez "hydro-", puis le nom de l'atome non-hydrogène, puis "-ic". Vous devrez généralement laisser tomber une lettre ou 2 du nom de l'atome pour que le mot «circule» correctement - ceci est généralement assez intuitif. Terminez avec le mot "acide".
2 Utilisez la formule "acide hydro- (acide)" s'il n'y a pas d'atome d'oxygène. Nommer des acides sans atome d'oxygène est facile. D'abord, écrivez "hydro-", puis le nom de l'atome non-hydrogène, puis "-ic". Vous devrez généralement laisser tomber une lettre ou 2 du nom de l'atome pour que le mot «circule» correctement - ceci est généralement assez intuitif. Terminez avec le mot "acide". - Par exemple, HCl devient "acide hydrochlorique."
- D'autres exemples comprennent HF (acide fluorhydrique) et HI (acide iodhydrique).
-
 3 Nommez l'anion oxygène en premier s'il y a un atome d'oxygène. Les acides qui contiennent de l'oxygène sont un peu plus difficiles à nommer. Il est généralement plus facile de commencer par nommer l'anion oxygène (la partie de la molécule qui a une charge négative en oxygène). Habituellement, c'est la partie qui est ne pas les hydrogènes. Suivez les étapes ci-dessous pour nommer les anions oxygène:[8]
3 Nommez l'anion oxygène en premier s'il y a un atome d'oxygène. Les acides qui contiennent de l'oxygène sont un peu plus difficiles à nommer. Il est généralement plus facile de commencer par nommer l'anion oxygène (la partie de la molécule qui a une charge négative en oxygène). Habituellement, c'est la partie qui est ne pas les hydrogènes. Suivez les étapes ci-dessous pour nommer les anions oxygène:[8] -
 4 Déterminez combien d'anions sont dans la même série que la vôtre. Les anions sont dans la même série lorsque vous pouvez ajouter ou soustraire des oxygènes et conserver la même charge globale en modifiant l'état d'oxydation du cation (la partie chargée positivement de l'anion). Un bon guide sur les états d'oxydation est disponible ici.[9]
4 Déterminez combien d'anions sont dans la même série que la vôtre. Les anions sont dans la même série lorsque vous pouvez ajouter ou soustraire des oxygènes et conserver la même charge globale en modifiant l'état d'oxydation du cation (la partie chargée positivement de l'anion). Un bon guide sur les états d'oxydation est disponible ici.[9] - S'il y a 2 anions dans la même série, le 1 avec moins d'oxygène finit avec -ite et le 1 avec plus d'oxygène finit avec -ate. Par exemple, SO32- et donc42- sont tous deux possibles selon que S a un état d'oxydation de 4+ ou 6+. Le premier est sulfite et le second est sulfate basé sur leur nombre d'oxygène.
- S'il y a plus de 2 anions dans la même série, utilisez le préfixe "hypo" pour le 1 avec le moins d'oxygène et le préfixe "per" pour le 1 avec le plus d'oxygène. Par exemple, le chlore peut former ClO-, ClO2-, ClO3-et ClO4-. Ceux-ci sont nommés hypochlorite, chlorite, chlorate, et perchlorate respectivement.
-
 5 Utilisez le nom de l'anion oxygène pour trouver le nom de l'acide. Maintenant que vous avez nommé l'anion oxygène, trouver le nom de l'acide n'est pas difficile. Utilisez les règles de dénomination suivantes:
5 Utilisez le nom de l'anion oxygène pour trouver le nom de l'acide. Maintenant que vous avez nommé l'anion oxygène, trouver le nom de l'acide n'est pas difficile. Utilisez les règles de dénomination suivantes: - Si l'anion se termine in -ate, l'acide se termine par -ric ou -ic.
-
- Exemple: HClO2 est acide chloreux (du "chlorate", le nom de l'anion oxygène).
-
- Si l'anion se termine en -ite, l'acide se termine par -ous.
-
- Exemple: HClO3 est acide chlorique (de "chlorite", le nom de l'anion oxygène).
-
- Ajouter hypo- ou per au début si l'anion avait ces préfixes.
-
- Exemple: HClO4 est acide perchloré (à partir de "perchlorate", le nom de l'anion oxygène).
-
- Si l'anion se termine in -ate, l'acide se termine par -ric ou -ic.
-
 6 Identifier les exceptions concernant les noms d'acides. Comme avec les composés covalents normaux, certains acides ont des noms spéciaux qui ne sont pas conformes aux règles de dénomination normales. Il n'y a pas de moyen facile de les apprendre, mais ils sont faciles à mémoriser au fur et à mesure que vous les rencontrez. Voici quelques exemples:
6 Identifier les exceptions concernant les noms d'acides. Comme avec les composés covalents normaux, certains acides ont des noms spéciaux qui ne sont pas conformes aux règles de dénomination normales. Il n'y a pas de moyen facile de les apprendre, mais ils sont faciles à mémoriser au fur et à mesure que vous les rencontrez. Voici quelques exemples: - HCN est "acide cyanhydrique". Ici, il n'y a pas d'oxygène, mais vous obtenez toujours le nom de l'anion CN - pas le nom de l'un ou l'autre atome.
- CH3COOH est "acide acétique." Techniquement, ce composé est nommé avec des règles de dénomination issues de la chimie organique, mais celles-ci n'entrent pas en jeu avec les composés covalents de base.
 Minotauromaquia
Minotauromaquia
 1 Nommez le premier élément du composé. Les formules moléculaires se lisent de gauche à droite, tout comme les mots anglais. Généralement, le premier atome (le 1 à gauche de la formule moléculaire) est également l'atome le moins abondant du composé. Ecrivez le nom de cet atome en premier.
1 Nommez le premier élément du composé. Les formules moléculaires se lisent de gauche à droite, tout comme les mots anglais. Généralement, le premier atome (le 1 à gauche de la formule moléculaire) est également l'atome le moins abondant du composé. Ecrivez le nom de cet atome en premier.  2 Écrivez le préfixe grec pour le numéro du deuxième atome. Ensuite, regardez le deuxième atome de la molécule. Détermine combien de fois il apparaît dans la molécule. C'est le nombre écrit en indice à côté dans la formule moléculaire. S'il n'y a pas de numéro à côté du deuxième atome, il apparaît une fois. Trouvez le préfixe grec approprié dans le tableau ci-dessus et écrivez-le ensuite.
2 Écrivez le préfixe grec pour le numéro du deuxième atome. Ensuite, regardez le deuxième atome de la molécule. Détermine combien de fois il apparaît dans la molécule. C'est le nombre écrit en indice à côté dans la formule moléculaire. S'il n'y a pas de numéro à côté du deuxième atome, il apparaît une fois. Trouvez le préfixe grec approprié dans le tableau ci-dessus et écrivez-le ensuite.  3 Nommez le deuxième atome et terminez-le avec "-ide." Maintenant, écrivez simplement le nom du deuxième atome comme s'il s'agissait d'un anion (ion chargé négativement). En d'autres termes, il suffit de coller "-ide" à la fin. Dans la plupart des cas, vous devrez laisser tomber une lettre ou 2 à la fin du nom, mais ceci est plus naturel au fur et à mesure que vous le faites. Par exemple, l'oxygène devient "oxyde", le chlore devient "chlorure", etc.[5]
3 Nommez le deuxième atome et terminez-le avec "-ide." Maintenant, écrivez simplement le nom du deuxième atome comme s'il s'agissait d'un anion (ion chargé négativement). En d'autres termes, il suffit de coller "-ide" à la fin. Dans la plupart des cas, vous devrez laisser tomber une lettre ou 2 à la fin du nom, mais ceci est plus naturel au fur et à mesure que vous le faites. Par exemple, l'oxygène devient "oxyde", le chlore devient "chlorure", etc.[5]  4 Ajoutez un préfixe grec au début s'il y en a plus d'un. Déterminez combien de fois le premier atome apparaît dans la molécule. Si vous avez la formule moléculaire, ce sera le nombre écrit en indice après le premier atome. Encore une fois, s'il n'y a pas de numéro, le premier atome apparaît une fois. Si l'atome Est-ce que apparaissent plus d'une fois, écrivez son préfixe grec au début du nom.
4 Ajoutez un préfixe grec au début s'il y en a plus d'un. Déterminez combien de fois le premier atome apparaît dans la molécule. Si vous avez la formule moléculaire, ce sera le nombre écrit en indice après le premier atome. Encore une fois, s'il n'y a pas de numéro, le premier atome apparaît une fois. Si l'atome Est-ce que apparaissent plus d'une fois, écrivez son préfixe grec au début du nom.  5 Mets le tout ensemble. Félicitations - vous avez terminé. Le nom de votre composé est écrit sous cette forme:
5 Mets le tout ensemble. Félicitations - vous avez terminé. Le nom de votre composé est écrit sous cette forme:  6 Sachez que certains composés sont des exceptions aux règles de nommage normales. Les règles ci-dessus vous seront utiles pour presque toutes les molécules covalentes binaires normales. Cependant, quelques molécules sélectionnées obtiennent des noms spéciaux qui sont presque toujours utilisés quand ils sont discutés dans des paramètres scientifiques. Il n'y a pas vraiment moyen de les prédire - il suffit de les apprendre. Quelques exemples incluent:[6]
6 Sachez que certains composés sont des exceptions aux règles de nommage normales. Les règles ci-dessus vous seront utiles pour presque toutes les molécules covalentes binaires normales. Cependant, quelques molécules sélectionnées obtiennent des noms spéciaux qui sont presque toujours utilisés quand ils sont discutés dans des paramètres scientifiques. Il n'y a pas vraiment moyen de les prédire - il suffit de les apprendre. Quelques exemples incluent:[6]  1 Vérifiez si l'acide contient un oxygène. Les acides sont des composés qui donnent des protons à des réactions chimiques. Souvent, les acides commencent avec un ou plusieurs atomes d’H, bien qu’il y ait des exceptions.[7] La première étape pour nommer un acide est simple: commencez par voir rapidement s'il y a de l'oxygène (O).
1 Vérifiez si l'acide contient un oxygène. Les acides sont des composés qui donnent des protons à des réactions chimiques. Souvent, les acides commencent avec un ou plusieurs atomes d’H, bien qu’il y ait des exceptions.[7] La première étape pour nommer un acide est simple: commencez par voir rapidement s'il y a de l'oxygène (O).  2 Utilisez la formule "acide hydro- (acide)" s'il n'y a pas d'atome d'oxygène. Nommer des acides sans atome d'oxygène est facile. D'abord, écrivez "hydro-", puis le nom de l'atome non-hydrogène, puis "-ic". Vous devrez généralement laisser tomber une lettre ou 2 du nom de l'atome pour que le mot «circule» correctement - ceci est généralement assez intuitif. Terminez avec le mot "acide".
2 Utilisez la formule "acide hydro- (acide)" s'il n'y a pas d'atome d'oxygène. Nommer des acides sans atome d'oxygène est facile. D'abord, écrivez "hydro-", puis le nom de l'atome non-hydrogène, puis "-ic". Vous devrez généralement laisser tomber une lettre ou 2 du nom de l'atome pour que le mot «circule» correctement - ceci est généralement assez intuitif. Terminez avec le mot "acide".  3 Nommez l'anion oxygène en premier s'il y a un atome d'oxygène. Les acides qui contiennent de l'oxygène sont un peu plus difficiles à nommer. Il est généralement plus facile de commencer par nommer l'anion oxygène (la partie de la molécule qui a une charge négative en oxygène). Habituellement, c'est la partie qui est ne pas les hydrogènes. Suivez les étapes ci-dessous pour nommer les anions oxygène:[8]
3 Nommez l'anion oxygène en premier s'il y a un atome d'oxygène. Les acides qui contiennent de l'oxygène sont un peu plus difficiles à nommer. Il est généralement plus facile de commencer par nommer l'anion oxygène (la partie de la molécule qui a une charge négative en oxygène). Habituellement, c'est la partie qui est ne pas les hydrogènes. Suivez les étapes ci-dessous pour nommer les anions oxygène:[8]  4 Déterminez combien d'anions sont dans la même série que la vôtre. Les anions sont dans la même série lorsque vous pouvez ajouter ou soustraire des oxygènes et conserver la même charge globale en modifiant l'état d'oxydation du cation (la partie chargée positivement de l'anion). Un bon guide sur les états d'oxydation est disponible ici.[9]
4 Déterminez combien d'anions sont dans la même série que la vôtre. Les anions sont dans la même série lorsque vous pouvez ajouter ou soustraire des oxygènes et conserver la même charge globale en modifiant l'état d'oxydation du cation (la partie chargée positivement de l'anion). Un bon guide sur les états d'oxydation est disponible ici.[9]  5 Utilisez le nom de l'anion oxygène pour trouver le nom de l'acide. Maintenant que vous avez nommé l'anion oxygène, trouver le nom de l'acide n'est pas difficile. Utilisez les règles de dénomination suivantes:
5 Utilisez le nom de l'anion oxygène pour trouver le nom de l'acide. Maintenant que vous avez nommé l'anion oxygène, trouver le nom de l'acide n'est pas difficile. Utilisez les règles de dénomination suivantes:  6 Identifier les exceptions concernant les noms d'acides. Comme avec les composés covalents normaux, certains acides ont des noms spéciaux qui ne sont pas conformes aux règles de dénomination normales. Il n'y a pas de moyen facile de les apprendre, mais ils sont faciles à mémoriser au fur et à mesure que vous les rencontrez. Voici quelques exemples:
6 Identifier les exceptions concernant les noms d'acides. Comme avec les composés covalents normaux, certains acides ont des noms spéciaux qui ne sont pas conformes aux règles de dénomination normales. Il n'y a pas de moyen facile de les apprendre, mais ils sont faciles à mémoriser au fur et à mesure que vous les rencontrez. Voici quelques exemples: