Vous avez probablement appris quelque part que l'eau est composée d'oxygène et d'hydrogène. Au lieu de prendre la parole de quelqu'un, vous pouvez le prouver en séparant l'eau dans ses composants. La technique la plus courante pour séparer les molécules d'eau est appelée électrolyse. Bien que l'électrolyse puisse être effectuée avec des fournitures ménagères, l'acide acétique (vinaigre) ne favorise pas suffisamment l'électrolyse pour générer une quantité notable de gaz. Vous pouvez le prouver par l'électrolyse au vinaigre, puis au bicarbonate de soude. Vous remarquerez que l'électrolyse au bicarbonate de soude produit beaucoup plus de gaz qu'avec le vinaigre.
Méthode One of Three:
Construire l'appareil
-
 1 Commencez avec une cuve vide. Vous pouvez utiliser une baignoire en plastique ou en verre. Évitez d'utiliser une baignoire en métal, car vous courrez un courant électrique dans l'eau. La taille de la baignoire n'a pas d'importance, mais un bon point de départ serait d'utiliser un 1⁄2 contenant de gallon (1,9 L).[1]
1 Commencez avec une cuve vide. Vous pouvez utiliser une baignoire en plastique ou en verre. Évitez d'utiliser une baignoire en métal, car vous courrez un courant électrique dans l'eau. La taille de la baignoire n'a pas d'importance, mais un bon point de départ serait d'utiliser un 1⁄2 contenant de gallon (1,9 L).[1] -
 2 Collez les pinces crocodiles au fond de la baignoire. Vous aurez besoin de 2 pinces crocodiles. L'un se connectera à votre électrode positive (l'anode) et l'autre se connectera à votre électrode négative (la cathode). Ruban une extrémité de chaque clip au fond de la baignoire. Veillez à laisser suffisamment d'espace pour pouvoir toujours ouvrir et fermer le clip.[2]
2 Collez les pinces crocodiles au fond de la baignoire. Vous aurez besoin de 2 pinces crocodiles. L'un se connectera à votre électrode positive (l'anode) et l'autre se connectera à votre électrode négative (la cathode). Ruban une extrémité de chaque clip au fond de la baignoire. Veillez à laisser suffisamment d'espace pour pouvoir toujours ouvrir et fermer le clip.[2] -
 3 Connectez les électrodes. Vous aurez besoin de 2 électrodes faites d'un matériau non réactif qui conduit bien l'électricité. Le platine est un choix optimal, mais si vous ne disposez pas d'électrodes en platine, vous pouvez utiliser du graphite. Raser le bois de 2 crayons pour faire 2 tiges de graphite. Attachez-en une à chaque pince crocodile à l'intérieur de la baignoire.
3 Connectez les électrodes. Vous aurez besoin de 2 électrodes faites d'un matériau non réactif qui conduit bien l'électricité. Le platine est un choix optimal, mais si vous ne disposez pas d'électrodes en platine, vous pouvez utiliser du graphite. Raser le bois de 2 crayons pour faire 2 tiges de graphite. Attachez-en une à chaque pince crocodile à l'intérieur de la baignoire. - Les baguettes en graphite sont d'excellentes électrodes car elles ne se dissolvent pas dans l'eau et conduisent l'électricité.
Méthode deux sur trois:
Électrolyse de l'eau et du vinaigre
-
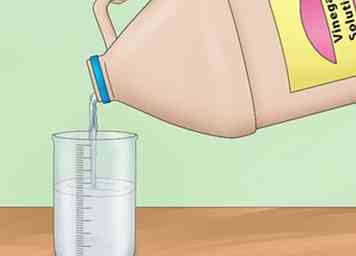 1 Mélanger une solution de vinaigre. Ajouter 5 cuillères à soupe (74 ml) de vinaigre à 1⁄2 gallon (1,9 L) d'eau. La solution obtenue sera légèrement acide et capable de conduire une petite quantité d'électricité. Verser la solution dans la baignoire.[3]
1 Mélanger une solution de vinaigre. Ajouter 5 cuillères à soupe (74 ml) de vinaigre à 1⁄2 gallon (1,9 L) d'eau. La solution obtenue sera légèrement acide et capable de conduire une petite quantité d'électricité. Verser la solution dans la baignoire.[3] - Vous pouvez ou non utiliser toute la solution. Il suffit de remplir la baignoire la plupart du temps.
-
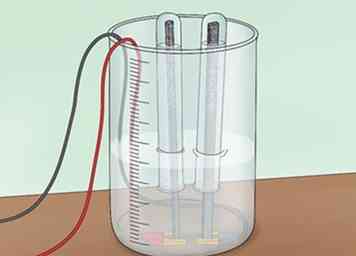 2 Inverser un tube à essai sur chaque électrode. Tout d'abord, remplissez 2 tubes à essai avec de l'eau. Vous pouvez les remplir du robinet ou de l'eau dans votre baignoire. Inverser chaque tube à essai sur l'une des électrodes de graphite et dans l'eau. Veillez à ne pas laisser de bulles d'air dans les tubes à essai. Ces tubes sont destinés à recueillir tout hydrogène ou oxygène formé.[4]
2 Inverser un tube à essai sur chaque électrode. Tout d'abord, remplissez 2 tubes à essai avec de l'eau. Vous pouvez les remplir du robinet ou de l'eau dans votre baignoire. Inverser chaque tube à essai sur l'une des électrodes de graphite et dans l'eau. Veillez à ne pas laisser de bulles d'air dans les tubes à essai. Ces tubes sont destinés à recueillir tout hydrogène ou oxygène formé.[4] - Vous devrez utiliser une pince pour maintenir les tubes à essai en place sur les tiges.
-
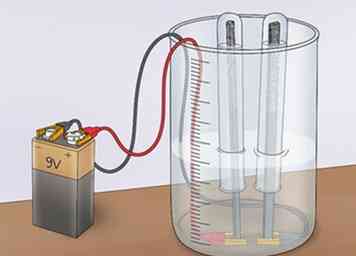 3 Connectez les pinces crocodiles à une alimentation. Connectez les pinces crocodiles (le côté opposé aux électrodes) à l'une des bornes d'une pile 9V. Cela complétera le circuit et permettra à l'électricité de circuler. Cependant, le courant sera limité par l'incapacité de la solution de vinaigre à bien se comporter. Cela confirmera que l'acide acétique dans le vinaigre ne favorise pas l'électrolyse de l'eau.[5]
3 Connectez les pinces crocodiles à une alimentation. Connectez les pinces crocodiles (le côté opposé aux électrodes) à l'une des bornes d'une pile 9V. Cela complétera le circuit et permettra à l'électricité de circuler. Cependant, le courant sera limité par l'incapacité de la solution de vinaigre à bien se comporter. Cela confirmera que l'acide acétique dans le vinaigre ne favorise pas l'électrolyse de l'eau.[5] - Cette limitation du courant interdit la séparation de l'eau en hydrogène et en oxygène.
- Le vinaigre est un acide faible, donc il ne se dissocie pas complètement lorsqu'il est dissous dans l'eau, ce qui signifie qu'il y a moins d'ions pour conduire l'électricité.
Méthode trois sur trois:
Électrolyse de l'eau et du bicarbonate de soude
-
 1 Remplir la cuve avec une solution de bicarbonate de sodium. Ajouter 1 cuillère à soupe (21 g) de bicarbonate de soude (bicarbonate de sodium) à 1⁄2 gallon (1,9 L) d'eau. Le bicarbonate de soude se dissoudra dans les électrolytes de la solution. Ces électrolytes augmenteront la quantité de courant que l'eau peut conduire. [6]
1 Remplir la cuve avec une solution de bicarbonate de sodium. Ajouter 1 cuillère à soupe (21 g) de bicarbonate de soude (bicarbonate de sodium) à 1⁄2 gallon (1,9 L) d'eau. Le bicarbonate de soude se dissoudra dans les électrolytes de la solution. Ces électrolytes augmenteront la quantité de courant que l'eau peut conduire. [6] - Le bicarbonate de soude forme des ions sodium et bicarbonate lorsqu'il est dissocié.
-
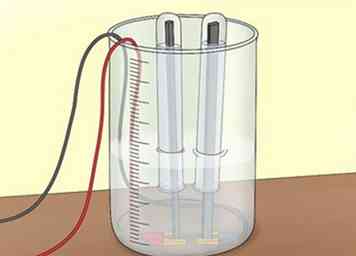 2 Couvrir les électrodes. Remplissez 2 tubes à essai avec de l'eau du robinet ou de la cuve. Retournez chaque tube à essai pour couvrir chaque électrode. Veillez à ne pas laisser entrer d’air dans les tubes à essai. Les tubes collecteront les gaz que vous produisez lors de l'électrolyse.[7]
2 Couvrir les électrodes. Remplissez 2 tubes à essai avec de l'eau du robinet ou de la cuve. Retournez chaque tube à essai pour couvrir chaque électrode. Veillez à ne pas laisser entrer d’air dans les tubes à essai. Les tubes collecteront les gaz que vous produisez lors de l'électrolyse.[7] - Utilisez une pince pour maintenir les tubes à essai en place sur les électrodes.
-
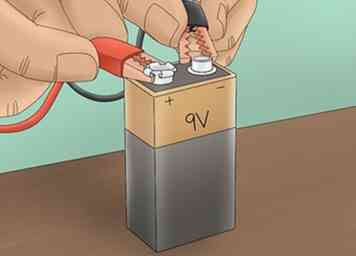 3 Connectez la source d'alimentation. Connecter 1 pince crocodile à la borne positive d'une pile de 9V. Connectez l'autre à la borne négative. Cela créera un circuit qui permettra au courant de circuler dans la solution d'électrolyte.
3 Connectez la source d'alimentation. Connecter 1 pince crocodile à la borne positive d'une pile de 9V. Connectez l'autre à la borne négative. Cela créera un circuit qui permettra au courant de circuler dans la solution d'électrolyte. -
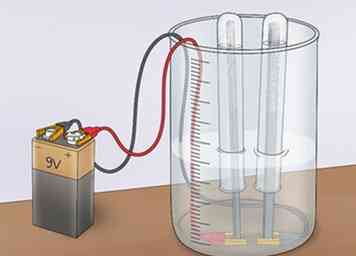 4 Regardez les bulles s'accumuler à l'anode et à la cathode. Au fur et à mesure que le courant circule dans la solution, certaines molécules d’eau se séparent. Le résultat sera l'hydrogène gazeux (H2) et d'oxygène gazeux (O2). Le gaz oxygène, qui a une charge de -2, sera attiré par une charge positive et s'accumulera sur l'anode (un accepteur d'électrons qui attire des charges négatives, appelées anions). Le gaz hydrogène, qui a une charge de +1, sera attiré par une charge négative et se rassemblera à la cathode (un accepteur d’électrons qui attire des charges positives, appelées cations).[8]
4 Regardez les bulles s'accumuler à l'anode et à la cathode. Au fur et à mesure que le courant circule dans la solution, certaines molécules d’eau se séparent. Le résultat sera l'hydrogène gazeux (H2) et d'oxygène gazeux (O2). Le gaz oxygène, qui a une charge de -2, sera attiré par une charge positive et s'accumulera sur l'anode (un accepteur d'électrons qui attire des charges négatives, appelées anions). Le gaz hydrogène, qui a une charge de +1, sera attiré par une charge négative et se rassemblera à la cathode (un accepteur d’électrons qui attire des charges positives, appelées cations).[8] - Au fur et à mesure que les gaz s'accumulent, ils sortent de l'eau autour de leurs électrodes respectives et sont capturés dans les tubes à essai.
- Vous remarquerez que l'eau est déplacée au sommet de l'éprouvette et remplacée par les gaz.
- Prenez note que le tube recouvrant la cathode déplace deux fois plus d'eau que le tube recouvrant l'anode. En effet, il existe deux fois plus de molécules d’hydrogène que les molécules d’oxygène.
 Minotauromaquia
Minotauromaquia
 1 Commencez avec une cuve vide. Vous pouvez utiliser une baignoire en plastique ou en verre. Évitez d'utiliser une baignoire en métal, car vous courrez un courant électrique dans l'eau. La taille de la baignoire n'a pas d'importance, mais un bon point de départ serait d'utiliser un
1 Commencez avec une cuve vide. Vous pouvez utiliser une baignoire en plastique ou en verre. Évitez d'utiliser une baignoire en métal, car vous courrez un courant électrique dans l'eau. La taille de la baignoire n'a pas d'importance, mais un bon point de départ serait d'utiliser un  2 Collez les pinces crocodiles au fond de la baignoire. Vous aurez besoin de 2 pinces crocodiles. L'un se connectera à votre électrode positive (l'anode) et l'autre se connectera à votre électrode négative (la cathode). Ruban une extrémité de chaque clip au fond de la baignoire. Veillez à laisser suffisamment d'espace pour pouvoir toujours ouvrir et fermer le clip.[2]
2 Collez les pinces crocodiles au fond de la baignoire. Vous aurez besoin de 2 pinces crocodiles. L'un se connectera à votre électrode positive (l'anode) et l'autre se connectera à votre électrode négative (la cathode). Ruban une extrémité de chaque clip au fond de la baignoire. Veillez à laisser suffisamment d'espace pour pouvoir toujours ouvrir et fermer le clip.[2]  3 Connectez les électrodes. Vous aurez besoin de 2 électrodes faites d'un matériau non réactif qui conduit bien l'électricité. Le platine est un choix optimal, mais si vous ne disposez pas d'électrodes en platine, vous pouvez utiliser du graphite. Raser le bois de 2 crayons pour faire 2 tiges de graphite. Attachez-en une à chaque pince crocodile à l'intérieur de la baignoire.
3 Connectez les électrodes. Vous aurez besoin de 2 électrodes faites d'un matériau non réactif qui conduit bien l'électricité. Le platine est un choix optimal, mais si vous ne disposez pas d'électrodes en platine, vous pouvez utiliser du graphite. Raser le bois de 2 crayons pour faire 2 tiges de graphite. Attachez-en une à chaque pince crocodile à l'intérieur de la baignoire.  1 Mélanger une solution de vinaigre. Ajouter 5 cuillères à soupe (74 ml) de vinaigre à
1 Mélanger une solution de vinaigre. Ajouter 5 cuillères à soupe (74 ml) de vinaigre à  2 Inverser un tube à essai sur chaque électrode. Tout d'abord, remplissez 2 tubes à essai avec de l'eau. Vous pouvez les remplir du robinet ou de l'eau dans votre baignoire. Inverser chaque tube à essai sur l'une des électrodes de graphite et dans l'eau. Veillez à ne pas laisser de bulles d'air dans les tubes à essai. Ces tubes sont destinés à recueillir tout hydrogène ou oxygène formé.[4]
2 Inverser un tube à essai sur chaque électrode. Tout d'abord, remplissez 2 tubes à essai avec de l'eau. Vous pouvez les remplir du robinet ou de l'eau dans votre baignoire. Inverser chaque tube à essai sur l'une des électrodes de graphite et dans l'eau. Veillez à ne pas laisser de bulles d'air dans les tubes à essai. Ces tubes sont destinés à recueillir tout hydrogène ou oxygène formé.[4]  3 Connectez les pinces crocodiles à une alimentation. Connectez les pinces crocodiles (le côté opposé aux électrodes) à l'une des bornes d'une pile 9V. Cela complétera le circuit et permettra à l'électricité de circuler. Cependant, le courant sera limité par l'incapacité de la solution de vinaigre à bien se comporter. Cela confirmera que l'acide acétique dans le vinaigre ne favorise pas l'électrolyse de l'eau.[5]
3 Connectez les pinces crocodiles à une alimentation. Connectez les pinces crocodiles (le côté opposé aux électrodes) à l'une des bornes d'une pile 9V. Cela complétera le circuit et permettra à l'électricité de circuler. Cependant, le courant sera limité par l'incapacité de la solution de vinaigre à bien se comporter. Cela confirmera que l'acide acétique dans le vinaigre ne favorise pas l'électrolyse de l'eau.[5]  1 Remplir la cuve avec une solution de bicarbonate de sodium. Ajouter 1 cuillère à soupe (21 g) de bicarbonate de soude (bicarbonate de sodium) à
1 Remplir la cuve avec une solution de bicarbonate de sodium. Ajouter 1 cuillère à soupe (21 g) de bicarbonate de soude (bicarbonate de sodium) à  2 Couvrir les électrodes. Remplissez 2 tubes à essai avec de l'eau du robinet ou de la cuve. Retournez chaque tube à essai pour couvrir chaque électrode. Veillez à ne pas laisser entrer d’air dans les tubes à essai. Les tubes collecteront les gaz que vous produisez lors de l'électrolyse.[7]
2 Couvrir les électrodes. Remplissez 2 tubes à essai avec de l'eau du robinet ou de la cuve. Retournez chaque tube à essai pour couvrir chaque électrode. Veillez à ne pas laisser entrer d’air dans les tubes à essai. Les tubes collecteront les gaz que vous produisez lors de l'électrolyse.[7]  3 Connectez la source d'alimentation. Connecter 1 pince crocodile à la borne positive d'une pile de 9V. Connectez l'autre à la borne négative. Cela créera un circuit qui permettra au courant de circuler dans la solution d'électrolyte.
3 Connectez la source d'alimentation. Connecter 1 pince crocodile à la borne positive d'une pile de 9V. Connectez l'autre à la borne négative. Cela créera un circuit qui permettra au courant de circuler dans la solution d'électrolyte.  4 Regardez les bulles s'accumuler à l'anode et à la cathode. Au fur et à mesure que le courant circule dans la solution, certaines molécules d’eau se séparent. Le résultat sera l'hydrogène gazeux (H2) et d'oxygène gazeux (O2). Le gaz oxygène, qui a une charge de -2, sera attiré par une charge positive et s'accumulera sur l'anode (un accepteur d'électrons qui attire des charges négatives, appelées anions). Le gaz hydrogène, qui a une charge de +1, sera attiré par une charge négative et se rassemblera à la cathode (un accepteur d’électrons qui attire des charges positives, appelées cations).[8]
4 Regardez les bulles s'accumuler à l'anode et à la cathode. Au fur et à mesure que le courant circule dans la solution, certaines molécules d’eau se séparent. Le résultat sera l'hydrogène gazeux (H2) et d'oxygène gazeux (O2). Le gaz oxygène, qui a une charge de -2, sera attiré par une charge positive et s'accumulera sur l'anode (un accepteur d'électrons qui attire des charges négatives, appelées anions). Le gaz hydrogène, qui a une charge de +1, sera attiré par une charge négative et se rassemblera à la cathode (un accepteur d’électrons qui attire des charges positives, appelées cations).[8]