Dans une réaction chimique, la matière ne peut ni être créée ni détruite conformément à la loi sur la conservation de la masse, de sorte que les produits qui en sortent doivent égaler les réactifs qui entrent en réaction. Cela signifie que la même quantité de chaque atome que vous mettez doit revenir. La stoechiométrie est la mesure des éléments dans une réaction.[1] Cela implique des calculs qui prennent en compte les masses de réactifs et de produits dans une réaction chimique donnée. La stoechiométrie est une demi-mathématique, une moitié de la chimie et s'articule autour du principe simple ci-dessus - le principe selon lequel la matière n'est jamais perdue ou gagnée lors d'une réaction. La première étape dans la résolution de tout problème chimique consiste à équilibrer l'équation.
Première partie de quatre:
Équilibrer l'équation chimique
-
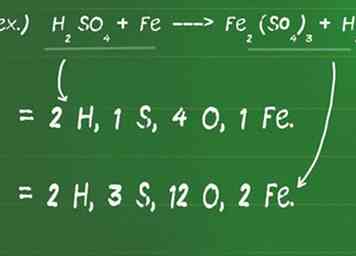 1 Notez le nombre d'atomes qui composent chaque composé de chaque côté de l'équation. En utilisant l'équation chimique, vous pouvez identifier les atomes de chaque élément de la réaction. Parce qu'une réaction chimique ne peut jamais créer ou détruire une nouvelle matière, une équation donnée est déséquilibrée si le nombre (et les types) d'atomes de chaque côté de l'équation ne correspondent pas parfaitement.
1 Notez le nombre d'atomes qui composent chaque composé de chaque côté de l'équation. En utilisant l'équation chimique, vous pouvez identifier les atomes de chaque élément de la réaction. Parce qu'une réaction chimique ne peut jamais créer ou détruire une nouvelle matière, une équation donnée est déséquilibrée si le nombre (et les types) d'atomes de chaque côté de l'équation ne correspondent pas parfaitement. - N'oubliez pas de multiplier par un coefficient ou un indice, s'il y en a un.
- Par exemple, H2ALORS4 + Fe ---> Fe2(ALORS4)3 + H2
- Sur le côté réactif (gauche) de l’équation, il y a 2 atomes d’H (H2), 1 atome de S, 4 atomes d’oxygène (O4), et 1 atome de Fe.
- Sur le côté produit (à droite) de l'équation, il y a 2H (H2), 3 atomes S (S3), 12 O atomes (O 12), et 2 atomes de fer (Fe2).
-
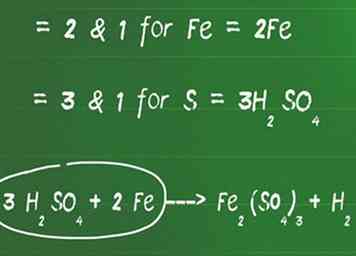 2 Ajouter un coefficient devant les éléments qui ne sont pas l'oxygène et l'hydrogène pour équilibrer chaque côté. Identifiez le facteur commun le plus bas entre tous les éléments qui ne sont pas de l'oxygène et de l'hydrogène (vous les équilibrerez ensuite) pour obtenir un nombre égal d'atomes des deux côtés.
2 Ajouter un coefficient devant les éléments qui ne sont pas l'oxygène et l'hydrogène pour équilibrer chaque côté. Identifiez le facteur commun le plus bas entre tous les éléments qui ne sont pas de l'oxygène et de l'hydrogène (vous les équilibrerez ensuite) pour obtenir un nombre égal d'atomes des deux côtés. - Par exemple, le facteur commun le plus bas entre 2 et 1 est 2 pour Fe. Ajouter un 2 devant le Fe sur le côté gauche pour l’équilibrer.
- Le plus petit facteur commun entre 3 et 1 est 3 pour S. Ajouter un 3 devant H2ALORS4 équilibrer les côtés gauche et droit.
- A ce stade, notre équation ressemble à ceci: 3 H2ALORS4 + 2 Fe ---> Fe2(ALORS4)3 + H2
-
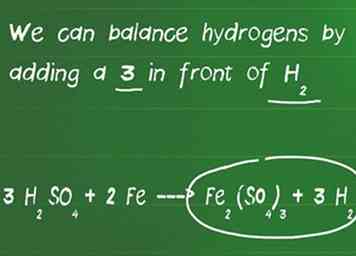 3 Équilibrez les atomes d'hydrogène et d'oxygène. Les atomes d'hydrogène et d'oxygène sont équilibrés en dernier, car ils apparaissent généralement dans plusieurs molécules de chaque côté de l'équation. À ce stade de l'équilibrage de l'équation, n'oubliez pas de recompter les atomes si vous avez ajouté des coefficients aux molécules.
3 Équilibrez les atomes d'hydrogène et d'oxygène. Les atomes d'hydrogène et d'oxygène sont équilibrés en dernier, car ils apparaissent généralement dans plusieurs molécules de chaque côté de l'équation. À ce stade de l'équilibrage de l'équation, n'oubliez pas de recompter les atomes si vous avez ajouté des coefficients aux molécules. - Dans notre exemple, nous avons ajouté un 3 devant H2ALORS4 et ont maintenant 6 hydrogènes à gauche et seulement 2 sur le côté droit de l'équation. Nous avons également 12 oxygènes à gauche et 12 oxygènes à droite, donc ils sont équilibrés.
- On peut équilibrer les hydrogènes en ajoutant un 3 devant H2.
- Notre dernière équation équilibrée est 3 H2ALORS4 + 2 Fe ---> Fe2(ALORS4)3 + 3 H2.
-
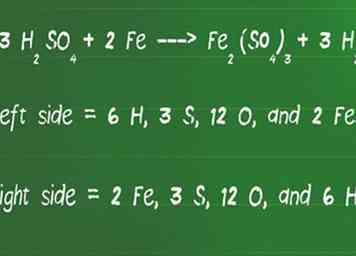 4 Recomptez le nombre d'atomes de chaque côté de l'équation pour vous assurer qu'ils sont égaux. Une fois que vous avez terminé, il est judicieux de revenir en arrière et de vérifier l'équation. Cela peut être fait en additionnant à nouveau tous les atomes de chaque côté de l'équation pour s'assurer qu'ils sont égaux des deux côtés.
4 Recomptez le nombre d'atomes de chaque côté de l'équation pour vous assurer qu'ils sont égaux. Une fois que vous avez terminé, il est judicieux de revenir en arrière et de vérifier l'équation. Cela peut être fait en additionnant à nouveau tous les atomes de chaque côté de l'équation pour s'assurer qu'ils sont égaux des deux côtés. - Vérifions notre équation, 3 H2ALORS4 + 2 Fe ---> Fe2(ALORS4)3 + 3 H2, pour l'équilibre.
- Sur le côté gauche de la flèche, il y a 6 H, 3 S, 12 O et 2 Fe.
- Sur le côté droit de la flèche, il y a 2 Fe, 3 S, 12 O et 6 H.
- Les côtés gauche et droit de l'équation correspondent donc, il est maintenant équilibré.
Deuxième partie de quatre:
Conversion entre des grammes et des taupes
-
 1 Calculez la masse molaire du composé en grammes. La masse molaire est la quantité en grammes (g) d'une mole d'un composé.[2] Il vous permet de convertir facilement entre grammes et moles d'une substance.[3] Pour calculer la masse molaire, vous devez identifier le nombre de molécules d'un élément dans le composé et la masse atomique de chaque élément dans le composé.
1 Calculez la masse molaire du composé en grammes. La masse molaire est la quantité en grammes (g) d'une mole d'un composé.[2] Il vous permet de convertir facilement entre grammes et moles d'une substance.[3] Pour calculer la masse molaire, vous devez identifier le nombre de molécules d'un élément dans le composé et la masse atomique de chaque élément dans le composé. - Définir le nombre d'atomes de chaque élément dans un composé. Par exemple, le glucose est C6H12O6, il y a 6 atomes de carbone, 12 atomes d'hydrogène et 6 atomes d'oxygène.
- Identifier la masse atomique en grammes par mole (g / mol) de chaque atome. Les masses atomiques de chaque élément se trouvent généralement sous le symbole de l'élément sur un tableau périodique, généralement sous forme décimale. Les masses atomiques des éléments en glucose sont: carbone, 12,0107 g / mol; hydrogène, 1,007 g / mol; et oxygène, 15,9994 g / mol.
- Multipliez la masse atomique de chaque élément par le nombre d'atomes présents dans le composé. Carbone: 12,0107 x 6 = 72,0642 g / mol; Hydrogène: 1,007 x 12 = 12,084 g / mol; Oxygène: 15,9994 x 6 = 95,9964 g / mol.
- L'ajout de ces produits ensemble donne la masse molaire du composé. 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. 180,14 grammes est la masse d'une mole de glucose.
-
 2 Convertir des grammes d'une substance en grains de beauté en utilisant une masse molaire. En utilisant la masse molaire comme facteur de conversion, vous pouvez calculer le nombre de grains de beauté présents dans le nombre indiqué de grammes de l'espèce. Diviser la quantité connue de grammes (g) par la masse molaire (g / mol).[4][5] Un moyen facile de vérifier que vous avez effectué les calculs corrects est de vous assurer que les unités s’annulent en ne laissant que des taupes.
2 Convertir des grammes d'une substance en grains de beauté en utilisant une masse molaire. En utilisant la masse molaire comme facteur de conversion, vous pouvez calculer le nombre de grains de beauté présents dans le nombre indiqué de grammes de l'espèce. Diviser la quantité connue de grammes (g) par la masse molaire (g / mol).[4][5] Un moyen facile de vérifier que vous avez effectué les calculs corrects est de vous assurer que les unités s’annulent en ne laissant que des taupes. - Par exemple: Combien de moles y a-t-il dans 8,2 grammes de chlorure d’hydrogène (HCl)?
- La masse atomique de H est de 1,007 et Cl est de 35,453 ce qui fait que la masse molaire du composé 1,007 + 35,453 = 36,46 g / mol.
- En divisant le nombre de grammes de la substance par les rendements en masse molaire: 8,2 g / (36,46 g / mol) = 0,225 mole d'HCl.
-
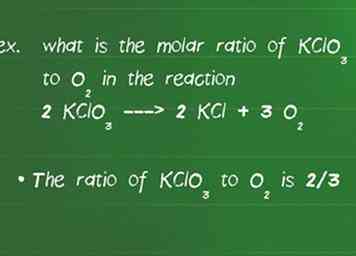 3 Déterminer le rapport molaire entre les réactifs. Afin de déterminer le rendement d'un produit dans une réaction donnée, vous devez déterminer le rapport molaire.Le rapport molaire vous indique le rapport dans lequel les substances réagissent entre elles et est donné par le coefficient de l'espèce dans la réaction équilibrée.[6]
3 Déterminer le rapport molaire entre les réactifs. Afin de déterminer le rendement d'un produit dans une réaction donnée, vous devez déterminer le rapport molaire.Le rapport molaire vous indique le rapport dans lequel les substances réagissent entre elles et est donné par le coefficient de l'espèce dans la réaction équilibrée.[6] - Par exemple, quel est le rapport molaire de KClO3 aussi2 dans la réaction 2 KClO3 ---> 2 KCl + 3 O2.
- Tout d'abord, vérifiez que l'équation est équilibrée. N'oubliez jamais cette étape ou vos ratios seront faux. Dans ce cas, il y a des quantités égales de chaque élément sur les deux côtés de la réaction afin qu'il soit équilibré.
- Le ratio de KClO3 aussi2 est 2/3. Peu importe le nombre qui passe en haut ou en bas, tant que vous gardez les mêmes composés sur le dessus et le bas pendant le reste du problème.[7]
-
 4 Multipliez par le rapport molaire pour trouver des moles d'autres réactifs. Pour calculer le nombre de moles d'une espèce produite ou requise pour une réaction, vous utiliserez le rapport molaire.[8] Les problèmes vous demanderont généralement de déterminer le nombre de moles requis ou le nombre de moles produites dans une réaction en fonction d’un certain nombre de grammes de réactif.
4 Multipliez par le rapport molaire pour trouver des moles d'autres réactifs. Pour calculer le nombre de moles d'une espèce produite ou requise pour une réaction, vous utiliserez le rapport molaire.[8] Les problèmes vous demanderont généralement de déterminer le nombre de moles requis ou le nombre de moles produites dans une réaction en fonction d’un certain nombre de grammes de réactif. - Par exemple, compte tenu de la réaction N2 + 3 H2 ---> 2 NH3 combien de taupes de NH3 sera produit 3,00 grammes de N2 réagissant avec suffisamment de H2?
- Dans cet exemple, suffisamment H2 Cela signifie qu'il y en a suffisamment et que vous n'avez pas à en tenir compte pour résoudre le problème.
- Tout d'abord, convertir des grammes de N2 aux taupes. La masse atomique de l'azote est de 14,0067 g / mol, donc la masse molaire de N2 est de 28,0134 g / mol. La division de la masse par la masse molaire donne 3,00 g / 28,0134 g / mol = 0,107 mol.
- Configurez les ratios donnés par la question: NH3: N2 = x / 0,107 mol.
- Croix multiplier ce rapport par le rapport molaire de NH3 tonne2: 2: 1. x / 0,107 mol = 2/1 = (2 x 0,107) = 1x = 0,214 mol.
-
 5 Convertir les taupes en masse en utilisant la masse molaire de l'espèce. Vous utiliserez à nouveau la masse molaire, mais cette fois, vous multiplierez pour convertir les taupes en grammes. Assurez-vous d'utiliser la masse molaire de l'espèce correcte.
5 Convertir les taupes en masse en utilisant la masse molaire de l'espèce. Vous utiliserez à nouveau la masse molaire, mais cette fois, vous multiplierez pour convertir les taupes en grammes. Assurez-vous d'utiliser la masse molaire de l'espèce correcte. - La masse molaire de NH3 est de 17,028 g / mol. Par conséquent, 0,214 mol x (17,028 grammes / mol) = 3,647 grammes de NH3.
Troisième partie de quatre:
Conversion entre litres de gaz et de taupes
-
 1 Déterminez si la réaction se produit à la température et à la pression standard (STP). STP est l'ensemble des conditions données lorsque 1 mole d'un gaz idéal occupera 22,414 litres (L) de volume.[9] La température standard est de 273,15 Kelvin (K) et la pression standard est de 1 atmosphère (atm).[10]
1 Déterminez si la réaction se produit à la température et à la pression standard (STP). STP est l'ensemble des conditions données lorsque 1 mole d'un gaz idéal occupera 22,414 litres (L) de volume.[9] La température standard est de 273,15 Kelvin (K) et la pression standard est de 1 atmosphère (atm).[10] - Généralement, une réaction dira qu'elle est donnée à 1 atm et 273 K ou dira simplement STP.
-
 2 Utilisez le facteur de conversion 22,414 L / mol pour convertir des litres de gaz en grains de beauté. Si votre réaction se produit à STP, vous pouvez utiliser 22,414 L / mol pour calculer le nombre de moles dans un volume de gaz donné.[11] Diviser le volume de gaz (L) par le facteur de conversion pour déterminer les grains de beauté.
2 Utilisez le facteur de conversion 22,414 L / mol pour convertir des litres de gaz en grains de beauté. Si votre réaction se produit à STP, vous pouvez utiliser 22,414 L / mol pour calculer le nombre de moles dans un volume de gaz donné.[11] Diviser le volume de gaz (L) par le facteur de conversion pour déterminer les grains de beauté. - Par exemple, convertir 3,2 litres de N2 gaz en moles: 3,2 L / 22,414 L / mol = 0,143 mole.
-
 3 Utilisez la loi sur les gaz parfaits pour convertir des litres de gaz non en STP. Si une réaction ne se produit pas au STP, vous devrez utiliser la loi des gaz parfaits PV = nRT pour déterminer le nombre de moles dans la réaction.[12] P est la pression dans les atmosphères, V le volume en litres, n le nombre de moles, R la constante de la loi des gaz à 0,0821 L-atm / mol-degree et T la température en degrés Kelvin.[13]
3 Utilisez la loi sur les gaz parfaits pour convertir des litres de gaz non en STP. Si une réaction ne se produit pas au STP, vous devrez utiliser la loi des gaz parfaits PV = nRT pour déterminer le nombre de moles dans la réaction.[12] P est la pression dans les atmosphères, V le volume en litres, n le nombre de moles, R la constante de la loi des gaz à 0,0821 L-atm / mol-degree et T la température en degrés Kelvin.[13] - L'équation peut être réorganisée pour résoudre les moles: n = RT / PV.
- Les unités de la constante de gaz sont conçues pour annuler les unités des autres variables.
- Par exemple, déterminer le nombre de moles dans 2,4 litres d’O2 à 300 K et 1,5 atm. Brancher les variables donne: n = (0,0821 x 300) / (1,5 x 2) = 24,63 / 3,6 = 6,842 moles d’O2
Partie quatre de quatre:
Conversion entre les litres de liquide et les taupes
-
 1 Calculez la densité du liquide. Parfois, les équations chimiques vous donneront le volume d'un réactif liquide et nécessitent la quantité de grammes ou de moles nécessaires pour la réaction. Pour convertir en grammes, vous utiliserez la densité de ce liquide. La densité est donnée en masse / volume.[14]
1 Calculez la densité du liquide. Parfois, les équations chimiques vous donneront le volume d'un réactif liquide et nécessitent la quantité de grammes ou de moles nécessaires pour la réaction. Pour convertir en grammes, vous utiliserez la densité de ce liquide. La densité est donnée en masse / volume.[14] - Si la densité n'est pas indiquée dans le problème, vous devrez peut-être la rechercher dans un texte de référence ou en ligne.
-
 2 Convertir le volume en millilitres (mL). Pour convertir le volume de liquide en masse (g), vous devrez utiliser la densité de ce liquide. La densité est donnée en grammes par millilitre (g / ml). Par conséquent, le volume du liquide doit être exprimé en millilitres à convertir.
2 Convertir le volume en millilitres (mL). Pour convertir le volume de liquide en masse (g), vous devrez utiliser la densité de ce liquide. La densité est donnée en grammes par millilitre (g / ml). Par conséquent, le volume du liquide doit être exprimé en millilitres à convertir. - Identifier le volume donné. Par exemple, disons que le problème indique que vous avez 1 litre de H2O. Pour convertir en mL, il suffit de multiplier par 1000. Il y a 1000 millilitres dans un litre d'eau.
-
 3 Multipliez le volume par la densité. Lorsque vous multipliez un volume (mL) par la densité de ce liquide (g / mL), les millilitres s'annulent et il vous reste des grammes de la substance.[15]
3 Multipliez le volume par la densité. Lorsque vous multipliez un volume (mL) par la densité de ce liquide (g / mL), les millilitres s'annulent et il vous reste des grammes de la substance.[15] - La densité de H2O, par exemple, est d'environ 1,0 g / ml.[16]
-
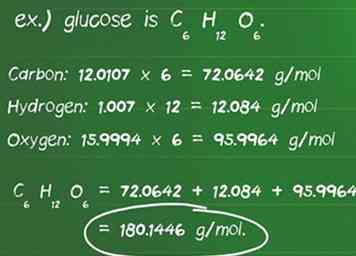 4 Calculez la masse molaire du réactif. La masse molaire est la quantité en grammes (g) d'une mole d'un composé. Il vous permet de convertir facilement entre grammes et moles d'une substance. Pour calculer la masse molaire, vous devez identifier le nombre de molécules d'un élément dans un composé et la masse atomique de chaque élément dans le composé.
4 Calculez la masse molaire du réactif. La masse molaire est la quantité en grammes (g) d'une mole d'un composé. Il vous permet de convertir facilement entre grammes et moles d'une substance. Pour calculer la masse molaire, vous devez identifier le nombre de molécules d'un élément dans un composé et la masse atomique de chaque élément dans le composé. - Définir le nombre d'atomes de chaque élément dans un composé. Par exemple, le glucose est C6H12O6, il y a 6 atomes de carbone, 12 atomes d'hydrogène et 6 atomes d'oxygène.
- Identifier la masse atomique en grammes par mole (g / mol) de chaque atome. Les masses atomiques des éléments en glucose sont: carbone, 12,0107 g / mol; hydrogène, 1,007 g / mol; et oxygène, 15,9994 g / mol.
- Multipliez chaque masse atomique d'éléments par le nombre d'atomes présents dans le composé.Carbone: 12,0107 x 6 = 72,0642 g / mol; Hydrogène: 1,007 x 12 = 12,084 g / mol; Oxygène: 15,9994 x 6 = 95,9964 g / mol.
- L'ajout de ces produits ensemble donne la masse molaire du composé. 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. 180,14 grammes est la masse d'une mole de glucose.
-
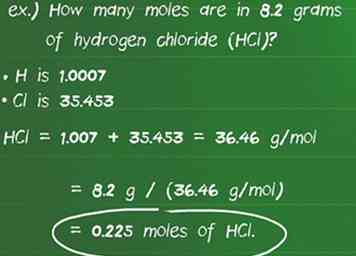 5 Convertir des grammes d'une substance en grains de beauté en utilisant une masse molaire. En utilisant la masse molaire comme facteur de conversion, vous pouvez calculer le nombre de grains de beauté présents dans le nombre indiqué de grammes de l'espèce. Diviser la quantité connue de grammes (g) par la masse molaire (g / mol).[17][18] Un moyen facile de vérifier que vous avez effectué les calculs corrects est de vous assurer que les unités s’annulent en ne laissant que des taupes.
5 Convertir des grammes d'une substance en grains de beauté en utilisant une masse molaire. En utilisant la masse molaire comme facteur de conversion, vous pouvez calculer le nombre de grains de beauté présents dans le nombre indiqué de grammes de l'espèce. Diviser la quantité connue de grammes (g) par la masse molaire (g / mol).[17][18] Un moyen facile de vérifier que vous avez effectué les calculs corrects est de vous assurer que les unités s’annulent en ne laissant que des taupes. - Par exemple: Combien de moles y a-t-il dans 8,2 grammes de chlorure d’hydrogène (HCl)?
- La masse atomique de H est de 1,007 et Cl est de 35,453 ce qui fait que la masse molaire du composé 1,007 + 35,453 = 36,46 g / mol.
- En divisant le nombre de grammes de la substance par les rendements en masse molaire: 8,2 g / (36,46 g / mol) = 0,225 mole d'HCl.
 Minotauromaquia
Minotauromaquia
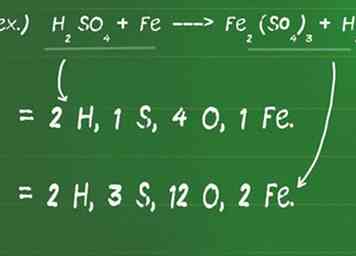 1 Notez le nombre d'atomes qui composent chaque composé de chaque côté de l'équation. En utilisant l'équation chimique, vous pouvez identifier les atomes de chaque élément de la réaction. Parce qu'une réaction chimique ne peut jamais créer ou détruire une nouvelle matière, une équation donnée est déséquilibrée si le nombre (et les types) d'atomes de chaque côté de l'équation ne correspondent pas parfaitement.
1 Notez le nombre d'atomes qui composent chaque composé de chaque côté de l'équation. En utilisant l'équation chimique, vous pouvez identifier les atomes de chaque élément de la réaction. Parce qu'une réaction chimique ne peut jamais créer ou détruire une nouvelle matière, une équation donnée est déséquilibrée si le nombre (et les types) d'atomes de chaque côté de l'équation ne correspondent pas parfaitement. 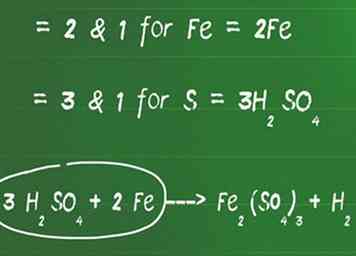 2 Ajouter un coefficient devant les éléments qui ne sont pas l'oxygène et l'hydrogène pour équilibrer chaque côté. Identifiez le facteur commun le plus bas entre tous les éléments qui ne sont pas de l'oxygène et de l'hydrogène (vous les équilibrerez ensuite) pour obtenir un nombre égal d'atomes des deux côtés.
2 Ajouter un coefficient devant les éléments qui ne sont pas l'oxygène et l'hydrogène pour équilibrer chaque côté. Identifiez le facteur commun le plus bas entre tous les éléments qui ne sont pas de l'oxygène et de l'hydrogène (vous les équilibrerez ensuite) pour obtenir un nombre égal d'atomes des deux côtés. 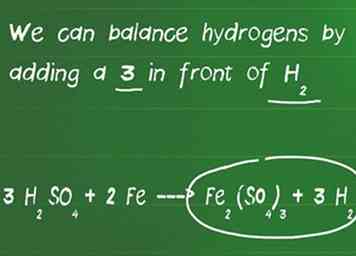 3 Équilibrez les atomes d'hydrogène et d'oxygène. Les atomes d'hydrogène et d'oxygène sont équilibrés en dernier, car ils apparaissent généralement dans plusieurs molécules de chaque côté de l'équation. À ce stade de l'équilibrage de l'équation, n'oubliez pas de recompter les atomes si vous avez ajouté des coefficients aux molécules.
3 Équilibrez les atomes d'hydrogène et d'oxygène. Les atomes d'hydrogène et d'oxygène sont équilibrés en dernier, car ils apparaissent généralement dans plusieurs molécules de chaque côté de l'équation. À ce stade de l'équilibrage de l'équation, n'oubliez pas de recompter les atomes si vous avez ajouté des coefficients aux molécules. 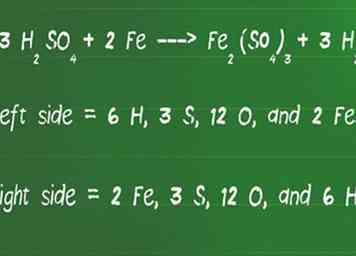 4 Recomptez le nombre d'atomes de chaque côté de l'équation pour vous assurer qu'ils sont égaux. Une fois que vous avez terminé, il est judicieux de revenir en arrière et de vérifier l'équation. Cela peut être fait en additionnant à nouveau tous les atomes de chaque côté de l'équation pour s'assurer qu'ils sont égaux des deux côtés.
4 Recomptez le nombre d'atomes de chaque côté de l'équation pour vous assurer qu'ils sont égaux. Une fois que vous avez terminé, il est judicieux de revenir en arrière et de vérifier l'équation. Cela peut être fait en additionnant à nouveau tous les atomes de chaque côté de l'équation pour s'assurer qu'ils sont égaux des deux côtés.  1 Calculez la masse molaire du composé en grammes. La masse molaire est la quantité en grammes (g) d'une mole d'un composé.[2] Il vous permet de convertir facilement entre grammes et moles d'une substance.[3] Pour calculer la masse molaire, vous devez identifier le nombre de molécules d'un élément dans le composé et la masse atomique de chaque élément dans le composé.
1 Calculez la masse molaire du composé en grammes. La masse molaire est la quantité en grammes (g) d'une mole d'un composé.[2] Il vous permet de convertir facilement entre grammes et moles d'une substance.[3] Pour calculer la masse molaire, vous devez identifier le nombre de molécules d'un élément dans le composé et la masse atomique de chaque élément dans le composé.  2 Convertir des grammes d'une substance en grains de beauté en utilisant une masse molaire. En utilisant la masse molaire comme facteur de conversion, vous pouvez calculer le nombre de grains de beauté présents dans le nombre indiqué de grammes de l'espèce. Diviser la quantité connue de grammes (g) par la masse molaire (g / mol).[4][5] Un moyen facile de vérifier que vous avez effectué les calculs corrects est de vous assurer que les unités s’annulent en ne laissant que des taupes.
2 Convertir des grammes d'une substance en grains de beauté en utilisant une masse molaire. En utilisant la masse molaire comme facteur de conversion, vous pouvez calculer le nombre de grains de beauté présents dans le nombre indiqué de grammes de l'espèce. Diviser la quantité connue de grammes (g) par la masse molaire (g / mol).[4][5] Un moyen facile de vérifier que vous avez effectué les calculs corrects est de vous assurer que les unités s’annulent en ne laissant que des taupes. 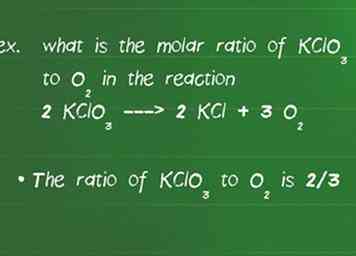 3 Déterminer le rapport molaire entre les réactifs. Afin de déterminer le rendement d'un produit dans une réaction donnée, vous devez déterminer le rapport molaire.Le rapport molaire vous indique le rapport dans lequel les substances réagissent entre elles et est donné par le coefficient de l'espèce dans la réaction équilibrée.[6]
3 Déterminer le rapport molaire entre les réactifs. Afin de déterminer le rendement d'un produit dans une réaction donnée, vous devez déterminer le rapport molaire.Le rapport molaire vous indique le rapport dans lequel les substances réagissent entre elles et est donné par le coefficient de l'espèce dans la réaction équilibrée.[6]  4 Multipliez par le rapport molaire pour trouver des moles d'autres réactifs. Pour calculer le nombre de moles d'une espèce produite ou requise pour une réaction, vous utiliserez le rapport molaire.[8] Les problèmes vous demanderont généralement de déterminer le nombre de moles requis ou le nombre de moles produites dans une réaction en fonction d’un certain nombre de grammes de réactif.
4 Multipliez par le rapport molaire pour trouver des moles d'autres réactifs. Pour calculer le nombre de moles d'une espèce produite ou requise pour une réaction, vous utiliserez le rapport molaire.[8] Les problèmes vous demanderont généralement de déterminer le nombre de moles requis ou le nombre de moles produites dans une réaction en fonction d’un certain nombre de grammes de réactif.  5 Convertir les taupes en masse en utilisant la masse molaire de l'espèce. Vous utiliserez à nouveau la masse molaire, mais cette fois, vous multiplierez pour convertir les taupes en grammes. Assurez-vous d'utiliser la masse molaire de l'espèce correcte.
5 Convertir les taupes en masse en utilisant la masse molaire de l'espèce. Vous utiliserez à nouveau la masse molaire, mais cette fois, vous multiplierez pour convertir les taupes en grammes. Assurez-vous d'utiliser la masse molaire de l'espèce correcte.  1 Déterminez si la réaction se produit à la température et à la pression standard (STP). STP est l'ensemble des conditions données lorsque 1 mole d'un gaz idéal occupera 22,414 litres (L) de volume.[9] La température standard est de 273,15 Kelvin (K) et la pression standard est de 1 atmosphère (atm).[10]
1 Déterminez si la réaction se produit à la température et à la pression standard (STP). STP est l'ensemble des conditions données lorsque 1 mole d'un gaz idéal occupera 22,414 litres (L) de volume.[9] La température standard est de 273,15 Kelvin (K) et la pression standard est de 1 atmosphère (atm).[10]  2 Utilisez le facteur de conversion 22,414 L / mol pour convertir des litres de gaz en grains de beauté. Si votre réaction se produit à STP, vous pouvez utiliser 22,414 L / mol pour calculer le nombre de moles dans un volume de gaz donné.[11] Diviser le volume de gaz (L) par le facteur de conversion pour déterminer les grains de beauté.
2 Utilisez le facteur de conversion 22,414 L / mol pour convertir des litres de gaz en grains de beauté. Si votre réaction se produit à STP, vous pouvez utiliser 22,414 L / mol pour calculer le nombre de moles dans un volume de gaz donné.[11] Diviser le volume de gaz (L) par le facteur de conversion pour déterminer les grains de beauté.  3 Utilisez la loi sur les gaz parfaits pour convertir des litres de gaz non en STP. Si une réaction ne se produit pas au STP, vous devrez utiliser la loi des gaz parfaits PV = nRT pour déterminer le nombre de moles dans la réaction.[12] P est la pression dans les atmosphères, V le volume en litres, n le nombre de moles, R la constante de la loi des gaz à 0,0821 L-atm / mol-degree et T la température en degrés Kelvin.[13]
3 Utilisez la loi sur les gaz parfaits pour convertir des litres de gaz non en STP. Si une réaction ne se produit pas au STP, vous devrez utiliser la loi des gaz parfaits PV = nRT pour déterminer le nombre de moles dans la réaction.[12] P est la pression dans les atmosphères, V le volume en litres, n le nombre de moles, R la constante de la loi des gaz à 0,0821 L-atm / mol-degree et T la température en degrés Kelvin.[13]  1 Calculez la densité du liquide. Parfois, les équations chimiques vous donneront le volume d'un réactif liquide et nécessitent la quantité de grammes ou de moles nécessaires pour la réaction. Pour convertir en grammes, vous utiliserez la densité de ce liquide. La densité est donnée en masse / volume.[14]
1 Calculez la densité du liquide. Parfois, les équations chimiques vous donneront le volume d'un réactif liquide et nécessitent la quantité de grammes ou de moles nécessaires pour la réaction. Pour convertir en grammes, vous utiliserez la densité de ce liquide. La densité est donnée en masse / volume.[14]  2 Convertir le volume en millilitres (mL). Pour convertir le volume de liquide en masse (g), vous devrez utiliser la densité de ce liquide. La densité est donnée en grammes par millilitre (g / ml). Par conséquent, le volume du liquide doit être exprimé en millilitres à convertir.
2 Convertir le volume en millilitres (mL). Pour convertir le volume de liquide en masse (g), vous devrez utiliser la densité de ce liquide. La densité est donnée en grammes par millilitre (g / ml). Par conséquent, le volume du liquide doit être exprimé en millilitres à convertir.  3 Multipliez le volume par la densité. Lorsque vous multipliez un volume (mL) par la densité de ce liquide (g / mL), les millilitres s'annulent et il vous reste des grammes de la substance.[15]
3 Multipliez le volume par la densité. Lorsque vous multipliez un volume (mL) par la densité de ce liquide (g / mL), les millilitres s'annulent et il vous reste des grammes de la substance.[15] 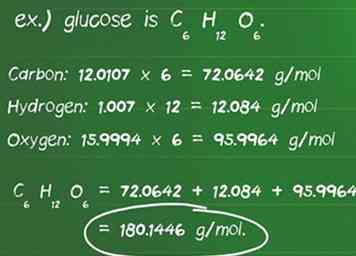 4 Calculez la masse molaire du réactif. La masse molaire est la quantité en grammes (g) d'une mole d'un composé. Il vous permet de convertir facilement entre grammes et moles d'une substance. Pour calculer la masse molaire, vous devez identifier le nombre de molécules d'un élément dans un composé et la masse atomique de chaque élément dans le composé.
4 Calculez la masse molaire du réactif. La masse molaire est la quantité en grammes (g) d'une mole d'un composé. Il vous permet de convertir facilement entre grammes et moles d'une substance. Pour calculer la masse molaire, vous devez identifier le nombre de molécules d'un élément dans un composé et la masse atomique de chaque élément dans le composé. 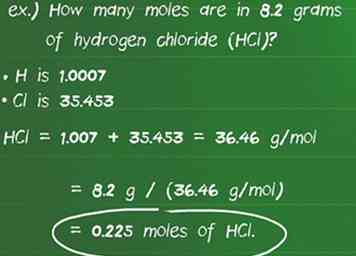 5 Convertir des grammes d'une substance en grains de beauté en utilisant une masse molaire. En utilisant la masse molaire comme facteur de conversion, vous pouvez calculer le nombre de grains de beauté présents dans le nombre indiqué de grammes de l'espèce. Diviser la quantité connue de grammes (g) par la masse molaire (g / mol).[17][18] Un moyen facile de vérifier que vous avez effectué les calculs corrects est de vous assurer que les unités s’annulent en ne laissant que des taupes.
5 Convertir des grammes d'une substance en grains de beauté en utilisant une masse molaire. En utilisant la masse molaire comme facteur de conversion, vous pouvez calculer le nombre de grains de beauté présents dans le nombre indiqué de grammes de l'espèce. Diviser la quantité connue de grammes (g) par la masse molaire (g / mol).[17][18] Un moyen facile de vérifier que vous avez effectué les calculs corrects est de vous assurer que les unités s’annulent en ne laissant que des taupes.