Le numéro atomique d'un élément est le nombre de protons dans le noyau d'un seul atome de cet élément. Le numéro atomique d'un élément ou d'un isotope ne peut pas changer, vous pouvez donc utiliser le numéro atomique pour déterminer d'autres caractéristiques, telles que le nombre d'électrons et de neutrons dans un atome.
Première partie de deux:
Trouver le numéro atomique
-
 1 Recherchez une copie du tableau périodique. Nous en avons un ici si vous n'en avez pas à portée de main. Chaque élément a un numéro atomique différent et les éléments sont classés sur la table en fonction de leurs numéros atomiques. C'est soit trouver une copie du tableau périodique, soit en mémoriser un.
1 Recherchez une copie du tableau périodique. Nous en avons un ici si vous n'en avez pas à portée de main. Chaque élément a un numéro atomique différent et les éléments sont classés sur la table en fonction de leurs numéros atomiques. C'est soit trouver une copie du tableau périodique, soit en mémoriser un. - La plupart des manuels de chimie ont un tableau périodique imprimé à l'intérieur de la couverture.
-
 2 Trouvez l'élément que vous étudiez. La plupart des tableaux périodiques incluent le nom complet des éléments, ainsi que le symbole chimique (tel que Hg pour Mercure). Si vous ne parvenez pas à le trouver, recherchez en ligne "symbole chimique" suivi du nom de l'élément.
2 Trouvez l'élément que vous étudiez. La plupart des tableaux périodiques incluent le nom complet des éléments, ainsi que le symbole chimique (tel que Hg pour Mercure). Si vous ne parvenez pas à le trouver, recherchez en ligne "symbole chimique" suivi du nom de l'élément. -
 3 Recherchez le numéro atomique. Le numéro atomique est généralement situé dans le coin supérieur gauche ou supérieur droit de la boîte de l'élément, mais il peut se trouver à un autre endroit. C'est toujours un nombre entier.
3 Recherchez le numéro atomique. Le numéro atomique est généralement situé dans le coin supérieur gauche ou supérieur droit de la boîte de l'élément, mais il peut se trouver à un autre endroit. C'est toujours un nombre entier. - Si le nombre inclut un point décimal, vous regardez probablement la masse atomique à la place.
-
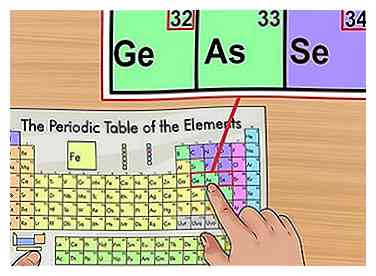 4 Confirmer en fonction des éléments proches. Le tableau périodique est organisé par ordre de numéro atomique. Si le numéro atomique de votre élément est "33", l'élément à gauche doit être "32" et l'élément à droite doit avoir "34". Si ce motif est vrai, vous avez définitivement trouvé le numéro atomique.
4 Confirmer en fonction des éléments proches. Le tableau périodique est organisé par ordre de numéro atomique. Si le numéro atomique de votre élément est "33", l'élément à gauche doit être "32" et l'élément à droite doit avoir "34". Si ce motif est vrai, vous avez définitivement trouvé le numéro atomique. - Vous pouvez voir des lacunes après les éléments 56 (baryum) et 88 (radium). Il n'y a pas d'écart réel; les éléments avec ces numéros atomiques sont situés sur deux lignes au-dessous du reste du graphique. Ils ne sont séparés que comme ceci pour s'adapter au tableau périodique dans une forme plus étroite.
-
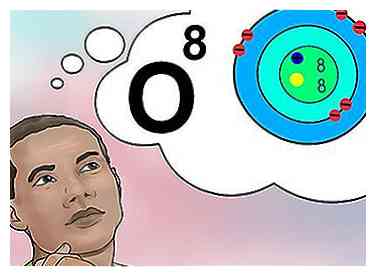 5 Comprendre le numéro atomique Le numéro atomique d'un élément a une définition simple: le nombre de protons dans un atome de cet élément.[1] C'est la définition fondamentale d'un élément. Le nombre de protons détermine la charge électrique totale du noyau, qui détermine le nombre d'électrons que l'atome peut supporter. Parce que les électrons sont responsables de presque toutes les interactions chimiques, le numéro atomique définit indirectement presque toutes les propriétés physiques et chimiques de l'élément.
5 Comprendre le numéro atomique Le numéro atomique d'un élément a une définition simple: le nombre de protons dans un atome de cet élément.[1] C'est la définition fondamentale d'un élément. Le nombre de protons détermine la charge électrique totale du noyau, qui détermine le nombre d'électrons que l'atome peut supporter. Parce que les électrons sont responsables de presque toutes les interactions chimiques, le numéro atomique définit indirectement presque toutes les propriétés physiques et chimiques de l'élément. - En d'autres termes, chaque atome de huit protons est un atome d'oxygène. Deux atomes d'oxygène peuvent avoir un nombre différent de neutrons ou (si l'on est un ion) un nombre d'électrons différent, mais ils auront toujours huit protons chacun.
Deuxième partie de deux:
Trouver des informations connexes
-
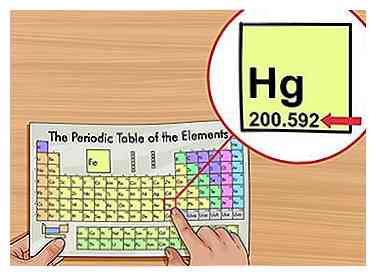 1 Trouvez le poids atomique. Le poids atomique est généralement imprimé sous le nom de l'élément dans le tableau périodique, généralement à deux ou trois décimales. C'est la masse moyenne d'un atome de l'élément, pondérée selon ce que vous vous attendez à trouver dans la nature. Ce nombre est en "unités de masse atomique" (AMU).
1 Trouvez le poids atomique. Le poids atomique est généralement imprimé sous le nom de l'élément dans le tableau périodique, généralement à deux ou trois décimales. C'est la masse moyenne d'un atome de l'élément, pondérée selon ce que vous vous attendez à trouver dans la nature. Ce nombre est en "unités de masse atomique" (AMU). - Certains scientifiques préfèrent le terme "masse atomique relative" au lieu de la masse atomique.[2]
-
 2 Arrondissez au nombre de masse. Le nombre de masse est le nombre total de protons et de neutrons dans un atome d'un élément. C'est facile à trouver: prenez simplement le poids atomique imprimé sur le tableau périodique et arrondissez au nombre entier le plus proche.[3]
2 Arrondissez au nombre de masse. Le nombre de masse est le nombre total de protons et de neutrons dans un atome d'un élément. C'est facile à trouver: prenez simplement le poids atomique imprimé sur le tableau périodique et arrondissez au nombre entier le plus proche.[3] - Cela fonctionne parce que les neutrons et les protons sont tous deux très proches de 1 UMA et que les électrons sont très proches de 0 UMA. Le poids atomique utilise des mesures précises pour obtenir la valeur décimale, mais nous ne sommes intéressés que par les nombres entiers qui nous indiquent le nombre de protons et de neutrons.
- Rappelez-vous que si vous utilisez le poids atomique, vous obtenez une moyenne pour un échantillon typique. Un échantillon de brome a un nombre de masse moyen de 80, mais il s'avère qu'un seul atome de brome a presque toujours un nombre de masse de 79 ou 81.[4]
- 3 Trouvez le nombre d'électrons. Les atomes contiennent le même nombre de protons et d'électrons, donc ces nombres seront les mêmes. Les électrons sont chargés négativement, donc ils équilibrent et neutralisent les protons, qui sont chargés positivement.[5]
- Si un atome perd ou gagne des électrons, il devient un ion, ce qui signifie qu'il s'agit d'un atome chargé électriquement.
-
 4 Calculez le nombre de neutrons. Maintenant, vous savez que le nombre atomique = nombre de protons et le nombre de masse = nombre de protons + nombre de neutrons. Pour trouver le nombre de neutrons dans un élément, soustrayez le numéro atomique du nombre de masse. Voici quelques exemples:
4 Calculez le nombre de neutrons. Maintenant, vous savez que le nombre atomique = nombre de protons et le nombre de masse = nombre de protons + nombre de neutrons. Pour trouver le nombre de neutrons dans un élément, soustrayez le numéro atomique du nombre de masse. Voici quelques exemples: - Un seul atome d’hélium (He) a un nombre de masse de 4 et un nombre atomique de 2. Il doit avoir 4 - 2 = 2 neutrons.
- Un échantillon d’argent (Ag) a un nombre de masse moyen de 108 (basé sur le tableau périodique) et un nombre atomique de 47. En moyenne, chaque atome d’argent de l’échantillon a 108 - 47 = 61 les neutrons.
-
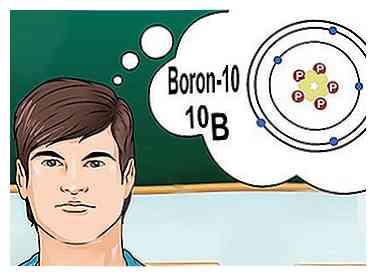 5 Comprendre les isotopes. Un isotope est une forme spécifique d'un élément, avec un certain nombre de neutrons. Si un problème de chimie mentionne "bore-10" ou "10B, "on parle d'éléments de bore avec un nombre de masse de 10.[6] Utilisez ce nombre de masse au lieu des valeurs pour le bore "typique".
5 Comprendre les isotopes. Un isotope est une forme spécifique d'un élément, avec un certain nombre de neutrons. Si un problème de chimie mentionne "bore-10" ou "10B, "on parle d'éléments de bore avec un nombre de masse de 10.[6] Utilisez ce nombre de masse au lieu des valeurs pour le bore "typique". - Les isotopes ne changent jamais le numéro atomique. Chaque isotope d'un élément a le même nombre de protons.
 Minotauromaquia
Minotauromaquia
 1 Recherchez une copie du tableau périodique. Nous en avons un ici si vous n'en avez pas à portée de main. Chaque élément a un numéro atomique différent et les éléments sont classés sur la table en fonction de leurs numéros atomiques. C'est soit trouver une copie du tableau périodique, soit en mémoriser un.
1 Recherchez une copie du tableau périodique. Nous en avons un ici si vous n'en avez pas à portée de main. Chaque élément a un numéro atomique différent et les éléments sont classés sur la table en fonction de leurs numéros atomiques. C'est soit trouver une copie du tableau périodique, soit en mémoriser un.  2 Trouvez l'élément que vous étudiez. La plupart des tableaux périodiques incluent le nom complet des éléments, ainsi que le symbole chimique (tel que Hg pour Mercure). Si vous ne parvenez pas à le trouver, recherchez en ligne "symbole chimique" suivi du nom de l'élément.
2 Trouvez l'élément que vous étudiez. La plupart des tableaux périodiques incluent le nom complet des éléments, ainsi que le symbole chimique (tel que Hg pour Mercure). Si vous ne parvenez pas à le trouver, recherchez en ligne "symbole chimique" suivi du nom de l'élément.  3 Recherchez le numéro atomique. Le numéro atomique est généralement situé dans le coin supérieur gauche ou supérieur droit de la boîte de l'élément, mais il peut se trouver à un autre endroit. C'est toujours un nombre entier.
3 Recherchez le numéro atomique. Le numéro atomique est généralement situé dans le coin supérieur gauche ou supérieur droit de la boîte de l'élément, mais il peut se trouver à un autre endroit. C'est toujours un nombre entier.  4 Confirmer en fonction des éléments proches. Le tableau périodique est organisé par ordre de numéro atomique. Si le numéro atomique de votre élément est "33", l'élément à gauche doit être "32" et l'élément à droite doit avoir "34". Si ce motif est vrai, vous avez définitivement trouvé le numéro atomique.
4 Confirmer en fonction des éléments proches. Le tableau périodique est organisé par ordre de numéro atomique. Si le numéro atomique de votre élément est "33", l'élément à gauche doit être "32" et l'élément à droite doit avoir "34". Si ce motif est vrai, vous avez définitivement trouvé le numéro atomique.  5 Comprendre le numéro atomique Le numéro atomique d'un élément a une définition simple: le nombre de protons dans un atome de cet élément.[1] C'est la définition fondamentale d'un élément. Le nombre de protons détermine la charge électrique totale du noyau, qui détermine le nombre d'électrons que l'atome peut supporter. Parce que les électrons sont responsables de presque toutes les interactions chimiques, le numéro atomique définit indirectement presque toutes les propriétés physiques et chimiques de l'élément.
5 Comprendre le numéro atomique Le numéro atomique d'un élément a une définition simple: le nombre de protons dans un atome de cet élément.[1] C'est la définition fondamentale d'un élément. Le nombre de protons détermine la charge électrique totale du noyau, qui détermine le nombre d'électrons que l'atome peut supporter. Parce que les électrons sont responsables de presque toutes les interactions chimiques, le numéro atomique définit indirectement presque toutes les propriétés physiques et chimiques de l'élément.  1 Trouvez le poids atomique. Le poids atomique est généralement imprimé sous le nom de l'élément dans le tableau périodique, généralement à deux ou trois décimales. C'est la masse moyenne d'un atome de l'élément, pondérée selon ce que vous vous attendez à trouver dans la nature. Ce nombre est en "unités de masse atomique" (AMU).
1 Trouvez le poids atomique. Le poids atomique est généralement imprimé sous le nom de l'élément dans le tableau périodique, généralement à deux ou trois décimales. C'est la masse moyenne d'un atome de l'élément, pondérée selon ce que vous vous attendez à trouver dans la nature. Ce nombre est en "unités de masse atomique" (AMU).  2 Arrondissez au nombre de masse. Le nombre de masse est le nombre total de protons et de neutrons dans un atome d'un élément. C'est facile à trouver: prenez simplement le poids atomique imprimé sur le tableau périodique et arrondissez au nombre entier le plus proche.[3]
2 Arrondissez au nombre de masse. Le nombre de masse est le nombre total de protons et de neutrons dans un atome d'un élément. C'est facile à trouver: prenez simplement le poids atomique imprimé sur le tableau périodique et arrondissez au nombre entier le plus proche.[3]  4 Calculez le nombre de neutrons. Maintenant, vous savez que le nombre atomique = nombre de protons et le nombre de masse = nombre de protons + nombre de neutrons. Pour trouver le nombre de neutrons dans un élément, soustrayez le numéro atomique du nombre de masse. Voici quelques exemples:
4 Calculez le nombre de neutrons. Maintenant, vous savez que le nombre atomique = nombre de protons et le nombre de masse = nombre de protons + nombre de neutrons. Pour trouver le nombre de neutrons dans un élément, soustrayez le numéro atomique du nombre de masse. Voici quelques exemples:  5 Comprendre les isotopes. Un isotope est une forme spécifique d'un élément, avec un certain nombre de neutrons. Si un problème de chimie mentionne "bore-10" ou "10B, "on parle d'éléments de bore avec un nombre de masse de 10.[6] Utilisez ce nombre de masse au lieu des valeurs pour le bore "typique".
5 Comprendre les isotopes. Un isotope est une forme spécifique d'un élément, avec un certain nombre de neutrons. Si un problème de chimie mentionne "bore-10" ou "10B, "on parle d'éléments de bore avec un nombre de masse de 10.[6] Utilisez ce nombre de masse au lieu des valeurs pour le bore "typique".