Si on vous a assigné des devoirs où vous devez trouver la formule empirique d'un composé, mais que vous n'avez aucune idée de la manière de commencer, ne craignez jamais! wikiHow est là pour vous aider! Tout d'abord, examinez les connaissances de base dont vous avez besoin pour trouver la formule empirique, puis parcourez un exemple de la partie 2.
Méthode One of Two:
Comprendre les bases
-
 1 Savoir quelle est la formule empirique. En chimie, le FE est le moyen le plus simple de décrire un composé. Il s’agit d’une liste d’éléments composant un composé, organisés en pourcentage. Il est important de noter que cette formule simple ne décrit pas le arrangement des atomes dans le composé, il indique simplement de quel élément est composé le composé. Par exemple:
1 Savoir quelle est la formule empirique. En chimie, le FE est le moyen le plus simple de décrire un composé. Il s’agit d’une liste d’éléments composant un composé, organisés en pourcentage. Il est important de noter que cette formule simple ne décrit pas le arrangement des atomes dans le composé, il indique simplement de quel élément est composé le composé. Par exemple: - Un composé composé de 40,92% de carbone, de 4,58% d’hydrogène et de 54,5% d’oxygène aurait une formule empirique de C3H4O3 (nous allons passer en revue un exemple de la manière de trouver le FE de ce composé dans la deuxième partie).
-
 2 Comprendre le terme «composition en pourcentage». La «composition en pourcentage» fait référence au pourcentage de chaque atome dans le composé entier que nous examinons. Pour trouver la formule empirique d'un composé, il faut connaître la composition en pourcentage du composé. Si vous trouvez la formule empirique pour les devoirs, vous obtiendrez probablement les pourcentages.
2 Comprendre le terme «composition en pourcentage». La «composition en pourcentage» fait référence au pourcentage de chaque atome dans le composé entier que nous examinons. Pour trouver la formule empirique d'un composé, il faut connaître la composition en pourcentage du composé. Si vous trouvez la formule empirique pour les devoirs, vous obtiendrez probablement les pourcentages. - Dans un laboratoire de chimie, pour trouver la composition en pourcentage, le composé serait examiné par le biais de certaines expériences physiques, puis d'une analyse quantitative. À moins d'être dans un laboratoire, vous n'aurez pas besoin de faire ces expériences.
-
 3 Sachez que vous aurez affaire à des atomes de gramme. Un atome de gramme est la quantité spécifique d'un élément dont le poids en grammes est égal à sa masse atomique. Pour trouver un atome de gramme, l'équation est la suivante: Pourcentage de l'élément dans le composé (%) divisé par la masse atomique de l'élément.[1]
3 Sachez que vous aurez affaire à des atomes de gramme. Un atome de gramme est la quantité spécifique d'un élément dont le poids en grammes est égal à sa masse atomique. Pour trouver un atome de gramme, l'équation est la suivante: Pourcentage de l'élément dans le composé (%) divisé par la masse atomique de l'élément.[1] - Par exemple, disons que nous avons un composé composé de 40,92% de carbone. La masse atomique du carbone est de 12, donc notre équation serait 40,92 / 12 = 3,41.
-
 4 Savoir trouver le rapport atomique. Lorsque vous travaillez avec un composé, vous aurez plus d'un atome de gramme à calculer. Après avoir trouvé tous les atomes de gramme dans votre composé, regardez-les tous. Pour trouver le rapport atomique, vous devrez choisir l’atome de gramme le plus petit parmi tous les atomes de gramme que vous avez calculé. Vous allez alors diviser tous vos atomes de gramme par le plus petit atome de gramme. Par exemple:
4 Savoir trouver le rapport atomique. Lorsque vous travaillez avec un composé, vous aurez plus d'un atome de gramme à calculer. Après avoir trouvé tous les atomes de gramme dans votre composé, regardez-les tous. Pour trouver le rapport atomique, vous devrez choisir l’atome de gramme le plus petit parmi tous les atomes de gramme que vous avez calculé. Vous allez alors diviser tous vos atomes de gramme par le plus petit atome de gramme. Par exemple: - Disons que nous travaillons avec un composé qui a trois atomes de gramme: 1,5, 2 et 2,5. Le plus petit atome-gramme de ces trois nombres est 1,5. Donc, pour trouver le rapport atomique, vous devez diviser tous les nombres par 1,5, puis les séparer avec le symbole du ratio. :.
- 1,5 / 1,5 = 1. 2 / 1,5 = 1,33. 2,5 / 1,5 = 1,66. Donc votre rapport atomique est 1 : 1.33 : 1.66.
-
 5 Comprendre comment convertir les nombres de rapports atomiques en nombres entiers. Lorsque vous écrivez une formule empirique, vous avez besoin de nombres entiers. Cela signifie que vous ne pouvez pas utiliser un nombre comme 1.33. Une fois que vous avez trouvé votre ratio atomique, vous devez convertir tous les nombres partiels (encore une fois, comme 1,33) en nombres entiers (comme 3). Pour ce faire, vous devez trouver un nombre entier qui peut être multiplié par chaque nombre individuel dans votre rapport atomique pour obtenir un nombre entier. Par exemple:
5 Comprendre comment convertir les nombres de rapports atomiques en nombres entiers. Lorsque vous écrivez une formule empirique, vous avez besoin de nombres entiers. Cela signifie que vous ne pouvez pas utiliser un nombre comme 1.33. Une fois que vous avez trouvé votre ratio atomique, vous devez convertir tous les nombres partiels (encore une fois, comme 1,33) en nombres entiers (comme 3). Pour ce faire, vous devez trouver un nombre entier qui peut être multiplié par chaque nombre individuel dans votre rapport atomique pour obtenir un nombre entier. Par exemple: - Essayez 2. Multipliez les nombres dans votre rapport atomique (1, 1.33 et 1.66) par 2. Vous obtenez 2, 2.66 et 3.32. Ce ne sont pas des nombres entiers, donc 2 ne fonctionne pas.
- Essayez 3. Vous obtenez 3, 4 et 5 lorsque vous multipliez 1, 1,33 et 1,66 par 3. Par conséquent, votre rapport atomique des nombres entiers est 3 : 4 : 5.
-
 6 Comprendre ce que ces nombres entiers signifient pour la formule empirique. Le nombre entier que nous venons de résoudre correspond en fait à la formule empirique. Ces trois nombres entiers sont les petits nombres qui se trouvent au pied de chaque lettre et qui représentent un élément distinct du composé. Par exemple, notre formule empirique composée ressemblerait à:
6 Comprendre ce que ces nombres entiers signifient pour la formule empirique. Le nombre entier que nous venons de résoudre correspond en fait à la formule empirique. Ces trois nombres entiers sont les petits nombres qui se trouvent au pied de chaque lettre et qui représentent un élément distinct du composé. Par exemple, notre formule empirique composée ressemblerait à: - X3Y4Z5
Méthode deux sur deux:
Trouver la formule empirique
-
 1 Déterminez la composition en pourcentage de votre composé. Si vous essayez de trouver la formule empirique pour un devoir, vous obtiendrez probablement la composition en pourcentage, il vous suffit de savoir où chercher. Par exemple:
1 Déterminez la composition en pourcentage de votre composé. Si vous essayez de trouver la formule empirique pour un devoir, vous obtiendrez probablement la composition en pourcentage, il vous suffit de savoir où chercher. Par exemple: - Supposons que l'assignation vous demande de regarder un échantillon de vitamine C. Elle répertorie 40,92% de carbone, 4,58% d'hydrogène et 54,5% d'oxygène. Il s'agit du pourcentage de composition.
- 40,92% de la vitamine C est constituée de carbone, tandis que le reste est composé de 4,58% d’hydrogène et de 54,5% d’oxygène.
-
 2 Trouvez le nombre d'atomes de gramme dans le composé. Comme discuté dans la partie 1, l'équation pour trouver le nombre d'atomes de gramme est: Pourcentage de l'élément dans le composé (%) divisé par la masse atomique de l'élément. Pour notre exemple, la masse atomique du carbone est de 12, l'hydrogène est de 1 et l'oxygène de 16.
2 Trouvez le nombre d'atomes de gramme dans le composé. Comme discuté dans la partie 1, l'équation pour trouver le nombre d'atomes de gramme est: Pourcentage de l'élément dans le composé (%) divisé par la masse atomique de l'élément. Pour notre exemple, la masse atomique du carbone est de 12, l'hydrogène est de 1 et l'oxygène de 16. - Nombre d'atomes de carbone de carbone = 40,92 / 12 = 3,41
- Nombre d'atomes-grammes d'hydrogène = 04,58 / 01 = 4,58
- Nombre d'atomes d'oxygène gramme = 54.50 / 16 = 3.41
-
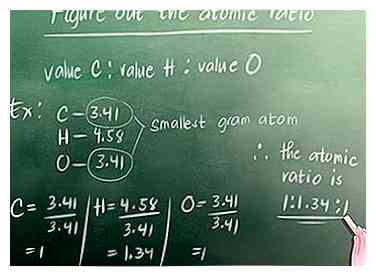 3 Calculez le rapport atomique. Recherchez l’atome de gramme qui est le plus petit de tous les atomes de gramme que nous venons de calculer. Pour notre exemple, il s’agit de 3,41 (carbone ou oxygène - ils ont tous deux la même valeur). Vous devez ensuite diviser toutes les valeurs de l'atome-gramme par ce nombre. Vous écrivez le ratio comme ceci: Valeur Carbone: valeur Hydrogène: valeur Oxygène.
3 Calculez le rapport atomique. Recherchez l’atome de gramme qui est le plus petit de tous les atomes de gramme que nous venons de calculer. Pour notre exemple, il s’agit de 3,41 (carbone ou oxygène - ils ont tous deux la même valeur). Vous devez ensuite diviser toutes les valeurs de l'atome-gramme par ce nombre. Vous écrivez le ratio comme ceci: Valeur Carbone: valeur Hydrogène: valeur Oxygène. - Carbone: 3,41 / 3,41 = 1
- Hydrogène: 4,58 / 3,41 = 1,34
- Oxygène: 3.41 / 3.41 = 1
- Le rapport atomique est 1 : 1.34 : 1.
-
 4 Convertissez le rapport en nombres entiers. Si votre rapport atomique contient des nombres entiers, vous pouvez ignorer cette étape. Pour notre exemple, cependant, nous devons convertir 1,34 en un nombre entier.Notre plus petit nombre entier pouvant être multiplié par les chiffres de notre rapport atomique pour créer des nombres entiers est 3.
4 Convertissez le rapport en nombres entiers. Si votre rapport atomique contient des nombres entiers, vous pouvez ignorer cette étape. Pour notre exemple, cependant, nous devons convertir 1,34 en un nombre entier.Notre plus petit nombre entier pouvant être multiplié par les chiffres de notre rapport atomique pour créer des nombres entiers est 3. - 1 x 3 = 3 (cela fonctionne parce que 3 est un nombre entier).
- 1,34 x 3 = 4 (4 est également un nombre entier).
- 1 x 3 = 3 (encore une fois, 3 est un nombre entier).
- Notre ratio de nombre entier est donc Carbone (C): Hydrogène (H): Oxygène (O) = 3 : 4 : 3
-
 5 Notez la formule empirique. Pour ce faire, il suffit d'écrire les lettres de chaque composant, en l'occurrence C pour le carbone, H pour l'hydrogène et O pour l'oxygène, avec leurs contre-parties complètes. La formule empirique de notre exemple est la suivante:
5 Notez la formule empirique. Pour ce faire, il suffit d'écrire les lettres de chaque composant, en l'occurrence C pour le carbone, H pour l'hydrogène et O pour l'oxygène, avec leurs contre-parties complètes. La formule empirique de notre exemple est la suivante: - C3H4O3
 Minotauromaquia
Minotauromaquia
 1 Savoir quelle est la formule empirique. En chimie, le FE est le moyen le plus simple de décrire un composé. Il s’agit d’une liste d’éléments composant un composé, organisés en pourcentage. Il est important de noter que cette formule simple ne décrit pas le arrangement des atomes dans le composé, il indique simplement de quel élément est composé le composé. Par exemple:
1 Savoir quelle est la formule empirique. En chimie, le FE est le moyen le plus simple de décrire un composé. Il s’agit d’une liste d’éléments composant un composé, organisés en pourcentage. Il est important de noter que cette formule simple ne décrit pas le arrangement des atomes dans le composé, il indique simplement de quel élément est composé le composé. Par exemple:  2 Comprendre le terme «composition en pourcentage». La «composition en pourcentage» fait référence au pourcentage de chaque atome dans le composé entier que nous examinons. Pour trouver la formule empirique d'un composé, il faut connaître la composition en pourcentage du composé. Si vous trouvez la formule empirique pour les devoirs, vous obtiendrez probablement les pourcentages.
2 Comprendre le terme «composition en pourcentage». La «composition en pourcentage» fait référence au pourcentage de chaque atome dans le composé entier que nous examinons. Pour trouver la formule empirique d'un composé, il faut connaître la composition en pourcentage du composé. Si vous trouvez la formule empirique pour les devoirs, vous obtiendrez probablement les pourcentages.  3 Sachez que vous aurez affaire à des atomes de gramme. Un atome de gramme est la quantité spécifique d'un élément dont le poids en grammes est égal à sa masse atomique. Pour trouver un atome de gramme, l'équation est la suivante: Pourcentage de l'élément dans le composé (%) divisé par la masse atomique de l'élément.[1]
3 Sachez que vous aurez affaire à des atomes de gramme. Un atome de gramme est la quantité spécifique d'un élément dont le poids en grammes est égal à sa masse atomique. Pour trouver un atome de gramme, l'équation est la suivante: Pourcentage de l'élément dans le composé (%) divisé par la masse atomique de l'élément.[1]  4 Savoir trouver le rapport atomique. Lorsque vous travaillez avec un composé, vous aurez plus d'un atome de gramme à calculer. Après avoir trouvé tous les atomes de gramme dans votre composé, regardez-les tous. Pour trouver le rapport atomique, vous devrez choisir l’atome de gramme le plus petit parmi tous les atomes de gramme que vous avez calculé. Vous allez alors diviser tous vos atomes de gramme par le plus petit atome de gramme. Par exemple:
4 Savoir trouver le rapport atomique. Lorsque vous travaillez avec un composé, vous aurez plus d'un atome de gramme à calculer. Après avoir trouvé tous les atomes de gramme dans votre composé, regardez-les tous. Pour trouver le rapport atomique, vous devrez choisir l’atome de gramme le plus petit parmi tous les atomes de gramme que vous avez calculé. Vous allez alors diviser tous vos atomes de gramme par le plus petit atome de gramme. Par exemple:  5 Comprendre comment convertir les nombres de rapports atomiques en nombres entiers. Lorsque vous écrivez une formule empirique, vous avez besoin de nombres entiers. Cela signifie que vous ne pouvez pas utiliser un nombre comme 1.33. Une fois que vous avez trouvé votre ratio atomique, vous devez convertir tous les nombres partiels (encore une fois, comme 1,33) en nombres entiers (comme 3). Pour ce faire, vous devez trouver un nombre entier qui peut être multiplié par chaque nombre individuel dans votre rapport atomique pour obtenir un nombre entier. Par exemple:
5 Comprendre comment convertir les nombres de rapports atomiques en nombres entiers. Lorsque vous écrivez une formule empirique, vous avez besoin de nombres entiers. Cela signifie que vous ne pouvez pas utiliser un nombre comme 1.33. Une fois que vous avez trouvé votre ratio atomique, vous devez convertir tous les nombres partiels (encore une fois, comme 1,33) en nombres entiers (comme 3). Pour ce faire, vous devez trouver un nombre entier qui peut être multiplié par chaque nombre individuel dans votre rapport atomique pour obtenir un nombre entier. Par exemple:  6 Comprendre ce que ces nombres entiers signifient pour la formule empirique. Le nombre entier que nous venons de résoudre correspond en fait à la formule empirique. Ces trois nombres entiers sont les petits nombres qui se trouvent au pied de chaque lettre et qui représentent un élément distinct du composé. Par exemple, notre formule empirique composée ressemblerait à:
6 Comprendre ce que ces nombres entiers signifient pour la formule empirique. Le nombre entier que nous venons de résoudre correspond en fait à la formule empirique. Ces trois nombres entiers sont les petits nombres qui se trouvent au pied de chaque lettre et qui représentent un élément distinct du composé. Par exemple, notre formule empirique composée ressemblerait à:  1 Déterminez la composition en pourcentage de votre composé. Si vous essayez de trouver la formule empirique pour un devoir, vous obtiendrez probablement la composition en pourcentage, il vous suffit de savoir où chercher. Par exemple:
1 Déterminez la composition en pourcentage de votre composé. Si vous essayez de trouver la formule empirique pour un devoir, vous obtiendrez probablement la composition en pourcentage, il vous suffit de savoir où chercher. Par exemple:  2 Trouvez le nombre d'atomes de gramme dans le composé. Comme discuté dans la partie 1, l'équation pour trouver le nombre d'atomes de gramme est: Pourcentage de l'élément dans le composé (%) divisé par la masse atomique de l'élément. Pour notre exemple, la masse atomique du carbone est de 12, l'hydrogène est de 1 et l'oxygène de 16.
2 Trouvez le nombre d'atomes de gramme dans le composé. Comme discuté dans la partie 1, l'équation pour trouver le nombre d'atomes de gramme est: Pourcentage de l'élément dans le composé (%) divisé par la masse atomique de l'élément. Pour notre exemple, la masse atomique du carbone est de 12, l'hydrogène est de 1 et l'oxygène de 16. 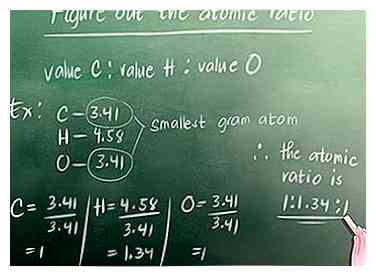 3 Calculez le rapport atomique. Recherchez l’atome de gramme qui est le plus petit de tous les atomes de gramme que nous venons de calculer. Pour notre exemple, il s’agit de 3,41 (carbone ou oxygène - ils ont tous deux la même valeur). Vous devez ensuite diviser toutes les valeurs de l'atome-gramme par ce nombre. Vous écrivez le ratio comme ceci: Valeur Carbone: valeur Hydrogène: valeur Oxygène.
3 Calculez le rapport atomique. Recherchez l’atome de gramme qui est le plus petit de tous les atomes de gramme que nous venons de calculer. Pour notre exemple, il s’agit de 3,41 (carbone ou oxygène - ils ont tous deux la même valeur). Vous devez ensuite diviser toutes les valeurs de l'atome-gramme par ce nombre. Vous écrivez le ratio comme ceci: Valeur Carbone: valeur Hydrogène: valeur Oxygène.  4 Convertissez le rapport en nombres entiers. Si votre rapport atomique contient des nombres entiers, vous pouvez ignorer cette étape. Pour notre exemple, cependant, nous devons convertir 1,34 en un nombre entier.Notre plus petit nombre entier pouvant être multiplié par les chiffres de notre rapport atomique pour créer des nombres entiers est 3.
4 Convertissez le rapport en nombres entiers. Si votre rapport atomique contient des nombres entiers, vous pouvez ignorer cette étape. Pour notre exemple, cependant, nous devons convertir 1,34 en un nombre entier.Notre plus petit nombre entier pouvant être multiplié par les chiffres de notre rapport atomique pour créer des nombres entiers est 3.  5 Notez la formule empirique. Pour ce faire, il suffit d'écrire les lettres de chaque composant, en l'occurrence C pour le carbone, H pour l'hydrogène et O pour l'oxygène, avec leurs contre-parties complètes. La formule empirique de notre exemple est la suivante:
5 Notez la formule empirique. Pour ce faire, il suffit d'écrire les lettres de chaque composant, en l'occurrence C pour le carbone, H pour l'hydrogène et O pour l'oxygène, avec leurs contre-parties complètes. La formule empirique de notre exemple est la suivante: