Bien que tous les atomes du même élément contiennent le même nombre de protons, leur nombre de neutrons peut varier. Savoir combien de neutrons se trouvent dans un atome particulier peut vous aider à déterminer s'il s'agit d'un atome régulier de cet élément ou d'un isotope, qui aura soit des neutrons supplémentaires, soit moins.[1] Déterminer le nombre de neutrons dans un atome est assez simple et ne nécessite même aucune expérimentation. Pour calculer le nombre de neutrons dans un atome régulier ou un isotope, il suffit de suivre ces instructions avec un tableau périodique en main.
Méthode One of Two:
Trouver le nombre de neutrons dans un atome régulier
-
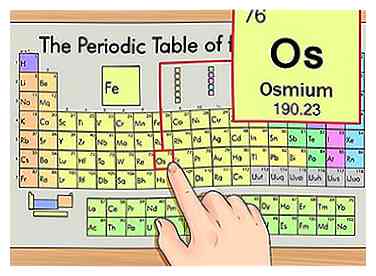 1 Localisez l'élément sur le tableau périodique. Pour cet exemple, nous allons examiner osmium (Os), qui est à la sixième rangée.
1 Localisez l'élément sur le tableau périodique. Pour cet exemple, nous allons examiner osmium (Os), qui est à la sixième rangée. -
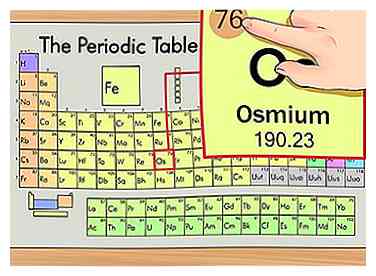 2 Trouvez le numéro atomique de l'élément. Cela a tendance à être le nombre le plus visible concernant un élément donné et se situe généralement au-dessus du symbole de l'élément, soit au milieu de la boîte, soit dans le coin supérieur gauche. (Sur le graphique, nous utilisons, en fait, aucun autre numéro n'est répertorié.) Le numéro atomique est le nombre de protons dans un seul atome de cet élément. Os est le numéro 76, ce qui signifie qu'un atome d'osmium contient 76 protons.
2 Trouvez le numéro atomique de l'élément. Cela a tendance à être le nombre le plus visible concernant un élément donné et se situe généralement au-dessus du symbole de l'élément, soit au milieu de la boîte, soit dans le coin supérieur gauche. (Sur le graphique, nous utilisons, en fait, aucun autre numéro n'est répertorié.) Le numéro atomique est le nombre de protons dans un seul atome de cet élément. Os est le numéro 76, ce qui signifie qu'un atome d'osmium contient 76 protons. - Le nombre de protons ne change jamais dans un élément; c'est essentiellement ce qui fait de cet élément cet élément.
-
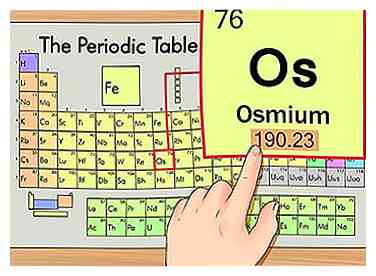 3 Trouvez le poids atomique de l'élément. Ce nombre se trouve généralement sous le symbole atomique. Notez que le graphique dans cet exemple est basé uniquement sur le numéro atomique et ne répertorie pas le poids atomique. Ce ne sera pas toujours le cas. L'osmium a un poids atomique de 190,23.
3 Trouvez le poids atomique de l'élément. Ce nombre se trouve généralement sous le symbole atomique. Notez que le graphique dans cet exemple est basé uniquement sur le numéro atomique et ne répertorie pas le poids atomique. Ce ne sera pas toujours le cas. L'osmium a un poids atomique de 190,23. -
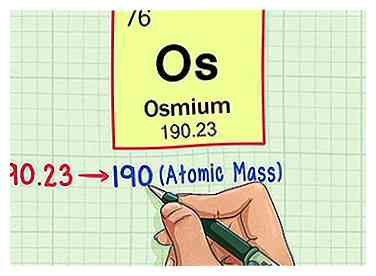 4 Arrondissez le poids atomique au nombre entier le plus proche pour trouver la masse atomique. Dans notre exemple, 190,23 seraient arrondis à 190, ce qui donnerait une masse atomique de 190 pour l'osmium.
4 Arrondissez le poids atomique au nombre entier le plus proche pour trouver la masse atomique. Dans notre exemple, 190,23 seraient arrondis à 190, ce qui donnerait une masse atomique de 190 pour l'osmium. - Le poids atomique est une moyenne des isotopes de l'élément, c'est pourquoi ce n'est généralement pas un nombre entier.
-
 5 Soustrayez le numéro atomique de la masse atomique. Étant donné que la grande majorité de la masse d'un atome est constituée de ses protons et de ses neutrons, la soustraction du nombre de protons (c'est-à-dire le numéro atomique) de la masse atomique vous donnera calculé nombre de neutrons dans l'atome. Les nombres après le point décimal représentent la très petite masse des électrons dans l'atome. Dans notre exemple, ceci est: 190 (poids atomique) - 76 (nombre de protons) = 114 (nombre de neutrons).
5 Soustrayez le numéro atomique de la masse atomique. Étant donné que la grande majorité de la masse d'un atome est constituée de ses protons et de ses neutrons, la soustraction du nombre de protons (c'est-à-dire le numéro atomique) de la masse atomique vous donnera calculé nombre de neutrons dans l'atome. Les nombres après le point décimal représentent la très petite masse des électrons dans l'atome. Dans notre exemple, ceci est: 190 (poids atomique) - 76 (nombre de protons) = 114 (nombre de neutrons). -
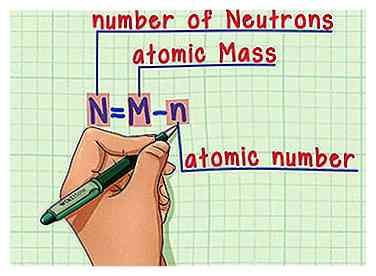 6 Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez simplement cette formule:
6 Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez simplement cette formule: - N = M - n
- N = nombre de Neutrons
- M = atomique Mcul
- n = atomique nombre
- N = M - n
Méthode deux sur deux:
Trouver le nombre de neutrons dans un isotope
-
 1 Localisez l'élément sur le tableau périodique. À titre d'exemple, nous examinerons l'isotope du carbone 14. Puisque la forme non isotopique du carbone 14 est simplement du carbone (C), trouvez du carbone dans le tableau périodique (dans la deuxième ligne du bas).
1 Localisez l'élément sur le tableau périodique. À titre d'exemple, nous examinerons l'isotope du carbone 14. Puisque la forme non isotopique du carbone 14 est simplement du carbone (C), trouvez du carbone dans le tableau périodique (dans la deuxième ligne du bas). -
 2 Trouvez le numéro atomique de l'élément. Cela a tendance à être le nombre le plus visible concernant un élément donné et se situe généralement au-dessus du symbole de l'élément. (Sur notre exemple de graphique, en fait, aucun autre numéro n'est répertorié.) Le nombre atomique est le nombre de protons dans un seul atome de cet élément. C est le numéro 6, ce qui signifie qu'un atome de carbone a 6 protons.
2 Trouvez le numéro atomique de l'élément. Cela a tendance à être le nombre le plus visible concernant un élément donné et se situe généralement au-dessus du symbole de l'élément. (Sur notre exemple de graphique, en fait, aucun autre numéro n'est répertorié.) Le nombre atomique est le nombre de protons dans un seul atome de cet élément. C est le numéro 6, ce qui signifie qu'un atome de carbone a 6 protons. -
 3 Trouvez la masse atomique. C'est incroyablement facile avec les isotopes, car ils sont nommés en fonction de leur masse atomique. Le carbone 14, par exemple, a une masse atomique de 14. Une fois que vous avez trouvé la masse atomique de l'isotope, le processus est le même que pour trouver le nombre de neutrons dans un atome régulier.
3 Trouvez la masse atomique. C'est incroyablement facile avec les isotopes, car ils sont nommés en fonction de leur masse atomique. Le carbone 14, par exemple, a une masse atomique de 14. Une fois que vous avez trouvé la masse atomique de l'isotope, le processus est le même que pour trouver le nombre de neutrons dans un atome régulier. -
 4 Soustrayez le numéro atomique de la masse atomique. Étant donné que la grande majorité de la masse d'un atome trouve ses protons et ses neutrons, la soustraction du nombre de protons (c'est-à-dire le numéro atomique) de la masse atomique vous donnera la calculé nombre de neutrons dans l'atome. Dans notre exemple, ceci est: 14 (masse atomique) - 6 (nombre de protons) = 8 (nombre de neutrons).
4 Soustrayez le numéro atomique de la masse atomique. Étant donné que la grande majorité de la masse d'un atome trouve ses protons et ses neutrons, la soustraction du nombre de protons (c'est-à-dire le numéro atomique) de la masse atomique vous donnera la calculé nombre de neutrons dans l'atome. Dans notre exemple, ceci est: 14 (masse atomique) - 6 (nombre de protons) = 8 (nombre de neutrons). -
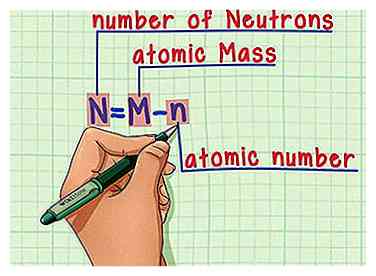 5 Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez simplement cette formule:
5 Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez simplement cette formule: - N = M - n
- N = nombre de Neutrons
- M = atomique Mcul
- n = atomique nombre
- N = M - n
 Minotauromaquia
Minotauromaquia
 1 Localisez l'élément sur le tableau périodique. Pour cet exemple, nous allons examiner osmium (Os), qui est à la sixième rangée.
1 Localisez l'élément sur le tableau périodique. Pour cet exemple, nous allons examiner osmium (Os), qui est à la sixième rangée.  2 Trouvez le numéro atomique de l'élément. Cela a tendance à être le nombre le plus visible concernant un élément donné et se situe généralement au-dessus du symbole de l'élément, soit au milieu de la boîte, soit dans le coin supérieur gauche. (Sur le graphique, nous utilisons, en fait, aucun autre numéro n'est répertorié.) Le numéro atomique est le nombre de protons dans un seul atome de cet élément. Os est le numéro 76, ce qui signifie qu'un atome d'osmium contient 76 protons.
2 Trouvez le numéro atomique de l'élément. Cela a tendance à être le nombre le plus visible concernant un élément donné et se situe généralement au-dessus du symbole de l'élément, soit au milieu de la boîte, soit dans le coin supérieur gauche. (Sur le graphique, nous utilisons, en fait, aucun autre numéro n'est répertorié.) Le numéro atomique est le nombre de protons dans un seul atome de cet élément. Os est le numéro 76, ce qui signifie qu'un atome d'osmium contient 76 protons.  3 Trouvez le poids atomique de l'élément. Ce nombre se trouve généralement sous le symbole atomique. Notez que le graphique dans cet exemple est basé uniquement sur le numéro atomique et ne répertorie pas le poids atomique. Ce ne sera pas toujours le cas. L'osmium a un poids atomique de 190,23.
3 Trouvez le poids atomique de l'élément. Ce nombre se trouve généralement sous le symbole atomique. Notez que le graphique dans cet exemple est basé uniquement sur le numéro atomique et ne répertorie pas le poids atomique. Ce ne sera pas toujours le cas. L'osmium a un poids atomique de 190,23.  4 Arrondissez le poids atomique au nombre entier le plus proche pour trouver la masse atomique. Dans notre exemple, 190,23 seraient arrondis à 190, ce qui donnerait une masse atomique de 190 pour l'osmium.
4 Arrondissez le poids atomique au nombre entier le plus proche pour trouver la masse atomique. Dans notre exemple, 190,23 seraient arrondis à 190, ce qui donnerait une masse atomique de 190 pour l'osmium.  5 Soustrayez le numéro atomique de la masse atomique. Étant donné que la grande majorité de la masse d'un atome est constituée de ses protons et de ses neutrons, la soustraction du nombre de protons (c'est-à-dire le numéro atomique) de la masse atomique vous donnera calculé nombre de neutrons dans l'atome. Les nombres après le point décimal représentent la très petite masse des électrons dans l'atome. Dans notre exemple, ceci est: 190 (poids atomique) - 76 (nombre de protons) = 114 (nombre de neutrons).
5 Soustrayez le numéro atomique de la masse atomique. Étant donné que la grande majorité de la masse d'un atome est constituée de ses protons et de ses neutrons, la soustraction du nombre de protons (c'est-à-dire le numéro atomique) de la masse atomique vous donnera calculé nombre de neutrons dans l'atome. Les nombres après le point décimal représentent la très petite masse des électrons dans l'atome. Dans notre exemple, ceci est: 190 (poids atomique) - 76 (nombre de protons) = 114 (nombre de neutrons).  6 Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez simplement cette formule:
6 Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez simplement cette formule:  1 Localisez l'élément sur le tableau périodique. À titre d'exemple, nous examinerons l'isotope du carbone 14. Puisque la forme non isotopique du carbone 14 est simplement du carbone (C), trouvez du carbone dans le tableau périodique (dans la deuxième ligne du bas).
1 Localisez l'élément sur le tableau périodique. À titre d'exemple, nous examinerons l'isotope du carbone 14. Puisque la forme non isotopique du carbone 14 est simplement du carbone (C), trouvez du carbone dans le tableau périodique (dans la deuxième ligne du bas).  2 Trouvez le numéro atomique de l'élément. Cela a tendance à être le nombre le plus visible concernant un élément donné et se situe généralement au-dessus du symbole de l'élément. (Sur notre exemple de graphique, en fait, aucun autre numéro n'est répertorié.) Le nombre atomique est le nombre de protons dans un seul atome de cet élément. C est le numéro 6, ce qui signifie qu'un atome de carbone a 6 protons.
2 Trouvez le numéro atomique de l'élément. Cela a tendance à être le nombre le plus visible concernant un élément donné et se situe généralement au-dessus du symbole de l'élément. (Sur notre exemple de graphique, en fait, aucun autre numéro n'est répertorié.) Le nombre atomique est le nombre de protons dans un seul atome de cet élément. C est le numéro 6, ce qui signifie qu'un atome de carbone a 6 protons.  3 Trouvez la masse atomique. C'est incroyablement facile avec les isotopes, car ils sont nommés en fonction de leur masse atomique. Le carbone 14, par exemple, a une masse atomique de 14. Une fois que vous avez trouvé la masse atomique de l'isotope, le processus est le même que pour trouver le nombre de neutrons dans un atome régulier.
3 Trouvez la masse atomique. C'est incroyablement facile avec les isotopes, car ils sont nommés en fonction de leur masse atomique. Le carbone 14, par exemple, a une masse atomique de 14. Une fois que vous avez trouvé la masse atomique de l'isotope, le processus est le même que pour trouver le nombre de neutrons dans un atome régulier.  4 Soustrayez le numéro atomique de la masse atomique. Étant donné que la grande majorité de la masse d'un atome trouve ses protons et ses neutrons, la soustraction du nombre de protons (c'est-à-dire le numéro atomique) de la masse atomique vous donnera la calculé nombre de neutrons dans l'atome. Dans notre exemple, ceci est: 14 (masse atomique) - 6 (nombre de protons) = 8 (nombre de neutrons).
4 Soustrayez le numéro atomique de la masse atomique. Étant donné que la grande majorité de la masse d'un atome trouve ses protons et ses neutrons, la soustraction du nombre de protons (c'est-à-dire le numéro atomique) de la masse atomique vous donnera la calculé nombre de neutrons dans l'atome. Dans notre exemple, ceci est: 14 (masse atomique) - 6 (nombre de protons) = 8 (nombre de neutrons).  5 Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez simplement cette formule:
5 Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez simplement cette formule: