Trouver le nombre de protons, de neutrons et d'électrons dans un élément donné n'est pas aussi difficile qu'il n'y parait. Souvent, une partie de votre réponse sera devant vous dans le tableau périodique! Une fois que vous savez où chercher, trouver le nombre de protons, de neutrons et d'électrons sera un jeu d'enfant.
Première partie de deux:
Calcul des protons, des électrons et des neutrons
-
 1 Obtenez un tableau périodique des éléments. Le tableau périodique est un graphique qui organise les éléments selon leur structure atomique. Il est codé en couleur et attribue à chaque élément une abréviation unique à 1 ou 2 lettres. D'autres informations élémentaires incluent la masse atomique et le numéro atomique.[1]
1 Obtenez un tableau périodique des éléments. Le tableau périodique est un graphique qui organise les éléments selon leur structure atomique. Il est codé en couleur et attribue à chaque élément une abréviation unique à 1 ou 2 lettres. D'autres informations élémentaires incluent la masse atomique et le numéro atomique.[1] - Vous pouvez trouver un tableau périodique en ligne ou dans un livre de chimie.
- Dans les tests, normalement, un tableau périodique sera fourni.
-
 2 Trouvez votre élément sur le tableau périodique. Le tableau classe les éléments par numéro atomique et les sépare en trois groupes principaux: les métaux, les non-métaux et les métalloïdes (semi-métaux). Les autres groupes d'éléments comprennent les métaux alcalins, les halogènes et les gaz rares.[2]
2 Trouvez votre élément sur le tableau périodique. Le tableau classe les éléments par numéro atomique et les sépare en trois groupes principaux: les métaux, les non-métaux et les métalloïdes (semi-métaux). Les autres groupes d'éléments comprennent les métaux alcalins, les halogènes et les gaz rares.[2] - L'utilisation du groupe (colonnes) ou du point (lignes) peut faciliter la localisation de l'élément sur la table.
- Vous pouvez également rechercher le symbole de l'élément dans la table si vous ne connaissez aucune autre propriété.
-
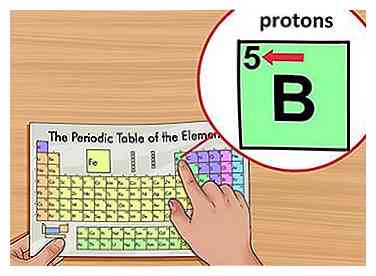 3 Localisez le numéro atomique de l'élément. Le numéro atomique est situé au-dessus du symbole de l'élément, dans le coin supérieur gauche du carré. Le numéro atomique vous indiquera combien de protons constituent un seul atome d'un élément.[3]
3 Localisez le numéro atomique de l'élément. Le numéro atomique est situé au-dessus du symbole de l'élément, dans le coin supérieur gauche du carré. Le numéro atomique vous indiquera combien de protons constituent un seul atome d'un élément.[3] - Par exemple, le bore (B) a un numéro atomique de 5, il a donc 5 protons.
-
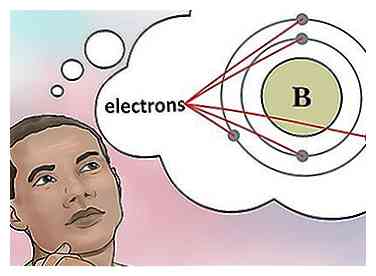 4 Détermine le nombre d'électrons. Les protons sont des particules dans le noyau d'un atome qui ont une charge positive égale à +1. Les électrons sont des particules qui ont une charge négative égale à -1. Par conséquent, un élément dans un état neutre aura le même nombre de protons et d'électrons.
4 Détermine le nombre d'électrons. Les protons sont des particules dans le noyau d'un atome qui ont une charge positive égale à +1. Les électrons sont des particules qui ont une charge négative égale à -1. Par conséquent, un élément dans un état neutre aura le même nombre de protons et d'électrons. - Par exemple, le bore (B) a un numéro atomique de 5, il a donc 5 protons et 5 électrons.
- Cependant, si l'élément contient un ion négatif ou positif, les protons et les électrons ne seront pas les mêmes. Vous devrez les calculer. Le nombre d'ions apparaîtra comme un petit exposant après l'élément.
-
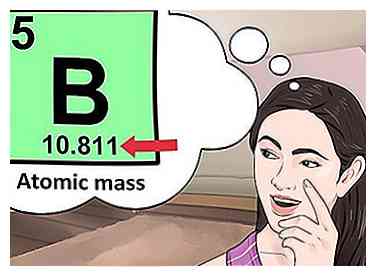 5 Recherchez la masse atomique de l'élément. Pour trouver le nombre de neutrons, vous devez d'abord trouver la masse atomique. La masse atomique d'un élément (aussi appelée masse atomique) est la masse moyenne pondérée des atomes d'un élément.[4] La masse atomique se trouve sous le symbole de l'élément.
5 Recherchez la masse atomique de l'élément. Pour trouver le nombre de neutrons, vous devez d'abord trouver la masse atomique. La masse atomique d'un élément (aussi appelée masse atomique) est la masse moyenne pondérée des atomes d'un élément.[4] La masse atomique se trouve sous le symbole de l'élément. - Assurez-vous que vous arrondissez la masse atomique au nombre entier le plus proche. Par exemple, la masse atomique du bore est de 10,811, mais vous pouvez simplement arrondir la masse atomique à 11.
-
 6 Soustrayez le numéro atomique de la masse atomique. Pour trouver le nombre de neutrons, vous devrez soustraire le numéro atomique de la masse atomique. Rappelez-vous que le numéro atomique est le même que le nombre de protons que vous avez déjà identifié.[5]
6 Soustrayez le numéro atomique de la masse atomique. Pour trouver le nombre de neutrons, vous devrez soustraire le numéro atomique de la masse atomique. Rappelez-vous que le numéro atomique est le même que le nombre de protons que vous avez déjà identifié.[5] - Pour notre exemple de bore, 11 (masse atomique) - 5 (numéro atomique) = 6 neutrons
Deuxième partie de deux:
Calcul des électrons avec des ions présents
-
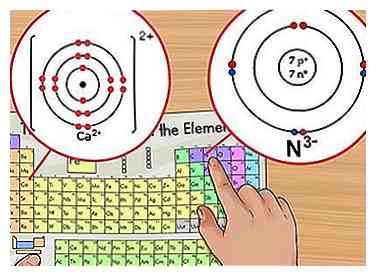 1 Identifier la charge nette. La charge nette d'un ion apparaîtra sous la forme d'un petit nombre en exposant après l'élément. Un ion est un atome qui a une charge positive ou négative due à l'addition ou à la suppression d'électrons.[6] Bien que le nombre de protons dans l'atome reste le même, le nombre d'électrons est modifié dans un ion.
1 Identifier la charge nette. La charge nette d'un ion apparaîtra sous la forme d'un petit nombre en exposant après l'élément. Un ion est un atome qui a une charge positive ou négative due à l'addition ou à la suppression d'électrons.[6] Bien que le nombre de protons dans l'atome reste le même, le nombre d'électrons est modifié dans un ion. - Parce qu'un électron a une charge négative, lorsque vous retirez des électrons, l'ion devient positif. Lorsque vous ajoutez plus d'électrons, l'ion devient négatif.
- Par exemple, N3- a une charge de -3 pendant que ca2+ a une charge de +2.
- N'oubliez pas que vous ne devez pas effectuer ce calcul s'il n'y a pas de nombre d'ions en exposant après l'élément.
-
 2 Soustraire la charge du numéro atomique. Lorsqu'un ion a une charge positive, l'atome a perdu des électrons. Pour calculer le nombre d'électrons restant, vous devez soustraire le montant de la charge supplémentaire du numéro atomique. Dans le cas d'un ion positif, il y a plus de protons que d'électrons.
2 Soustraire la charge du numéro atomique. Lorsqu'un ion a une charge positive, l'atome a perdu des électrons. Pour calculer le nombre d'électrons restant, vous devez soustraire le montant de la charge supplémentaire du numéro atomique. Dans le cas d'un ion positif, il y a plus de protons que d'électrons. - Par exemple, Ca2+ a une charge de +2, il a donc perdu 2 électrons de l’état neutre. Le numéro atomique du calcium est 20, donc l'ion a 18 électrons.
-
 3 Ajouter la charge au numéro atomique pour les ions négatifs. Lorsqu'un ion a une charge négative, l'atome a gagné des électrons. Pour calculer le nombre total d'électrons présents, il vous suffit d'ajouter la quantité de charge supplémentaire au numéro atomique. Dans le cas d'un ion négatif, il y a moins de protons que d'électrons.
3 Ajouter la charge au numéro atomique pour les ions négatifs. Lorsqu'un ion a une charge négative, l'atome a gagné des électrons. Pour calculer le nombre total d'électrons présents, il vous suffit d'ajouter la quantité de charge supplémentaire au numéro atomique. Dans le cas d'un ion négatif, il y a moins de protons que d'électrons. - Par exemple, N3- a une charge de -3; par conséquent, il a gagné 3 électrons par rapport à l'état neutre. Le numéro atomique de l'azote est 7, donc cet ion a 10 électrons.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Obtenez un tableau périodique des éléments. Le tableau périodique est un graphique qui organise les éléments selon leur structure atomique. Il est codé en couleur et attribue à chaque élément une abréviation unique à 1 ou 2 lettres. D'autres informations élémentaires incluent la masse atomique et le numéro atomique.[1]
1 Obtenez un tableau périodique des éléments. Le tableau périodique est un graphique qui organise les éléments selon leur structure atomique. Il est codé en couleur et attribue à chaque élément une abréviation unique à 1 ou 2 lettres. D'autres informations élémentaires incluent la masse atomique et le numéro atomique.[1]  2 Trouvez votre élément sur le tableau périodique. Le tableau classe les éléments par numéro atomique et les sépare en trois groupes principaux: les métaux, les non-métaux et les métalloïdes (semi-métaux). Les autres groupes d'éléments comprennent les métaux alcalins, les halogènes et les gaz rares.[2]
2 Trouvez votre élément sur le tableau périodique. Le tableau classe les éléments par numéro atomique et les sépare en trois groupes principaux: les métaux, les non-métaux et les métalloïdes (semi-métaux). Les autres groupes d'éléments comprennent les métaux alcalins, les halogènes et les gaz rares.[2]  3 Localisez le numéro atomique de l'élément. Le numéro atomique est situé au-dessus du symbole de l'élément, dans le coin supérieur gauche du carré. Le numéro atomique vous indiquera combien de protons constituent un seul atome d'un élément.[3]
3 Localisez le numéro atomique de l'élément. Le numéro atomique est situé au-dessus du symbole de l'élément, dans le coin supérieur gauche du carré. Le numéro atomique vous indiquera combien de protons constituent un seul atome d'un élément.[3]  4 Détermine le nombre d'électrons. Les protons sont des particules dans le noyau d'un atome qui ont une charge positive égale à +1. Les électrons sont des particules qui ont une charge négative égale à -1. Par conséquent, un élément dans un état neutre aura le même nombre de protons et d'électrons.
4 Détermine le nombre d'électrons. Les protons sont des particules dans le noyau d'un atome qui ont une charge positive égale à +1. Les électrons sont des particules qui ont une charge négative égale à -1. Par conséquent, un élément dans un état neutre aura le même nombre de protons et d'électrons. 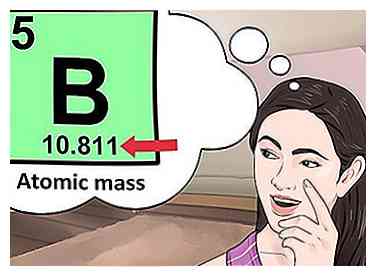 5 Recherchez la masse atomique de l'élément. Pour trouver le nombre de neutrons, vous devez d'abord trouver la masse atomique. La masse atomique d'un élément (aussi appelée masse atomique) est la masse moyenne pondérée des atomes d'un élément.[4] La masse atomique se trouve sous le symbole de l'élément.
5 Recherchez la masse atomique de l'élément. Pour trouver le nombre de neutrons, vous devez d'abord trouver la masse atomique. La masse atomique d'un élément (aussi appelée masse atomique) est la masse moyenne pondérée des atomes d'un élément.[4] La masse atomique se trouve sous le symbole de l'élément.  6 Soustrayez le numéro atomique de la masse atomique. Pour trouver le nombre de neutrons, vous devrez soustraire le numéro atomique de la masse atomique. Rappelez-vous que le numéro atomique est le même que le nombre de protons que vous avez déjà identifié.[5]
6 Soustrayez le numéro atomique de la masse atomique. Pour trouver le nombre de neutrons, vous devrez soustraire le numéro atomique de la masse atomique. Rappelez-vous que le numéro atomique est le même que le nombre de protons que vous avez déjà identifié.[5]  1 Identifier la charge nette. La charge nette d'un ion apparaîtra sous la forme d'un petit nombre en exposant après l'élément. Un ion est un atome qui a une charge positive ou négative due à l'addition ou à la suppression d'électrons.[6] Bien que le nombre de protons dans l'atome reste le même, le nombre d'électrons est modifié dans un ion.
1 Identifier la charge nette. La charge nette d'un ion apparaîtra sous la forme d'un petit nombre en exposant après l'élément. Un ion est un atome qui a une charge positive ou négative due à l'addition ou à la suppression d'électrons.[6] Bien que le nombre de protons dans l'atome reste le même, le nombre d'électrons est modifié dans un ion.  2 Soustraire la charge du numéro atomique. Lorsqu'un ion a une charge positive, l'atome a perdu des électrons. Pour calculer le nombre d'électrons restant, vous devez soustraire le montant de la charge supplémentaire du numéro atomique. Dans le cas d'un ion positif, il y a plus de protons que d'électrons.
2 Soustraire la charge du numéro atomique. Lorsqu'un ion a une charge positive, l'atome a perdu des électrons. Pour calculer le nombre d'électrons restant, vous devez soustraire le montant de la charge supplémentaire du numéro atomique. Dans le cas d'un ion positif, il y a plus de protons que d'électrons.  3 Ajouter la charge au numéro atomique pour les ions négatifs. Lorsqu'un ion a une charge négative, l'atome a gagné des électrons. Pour calculer le nombre total d'électrons présents, il vous suffit d'ajouter la quantité de charge supplémentaire au numéro atomique. Dans le cas d'un ion négatif, il y a moins de protons que d'électrons.
3 Ajouter la charge au numéro atomique pour les ions négatifs. Lorsqu'un ion a une charge négative, l'atome a gagné des électrons. Pour calculer le nombre total d'électrons présents, il vous suffit d'ajouter la quantité de charge supplémentaire au numéro atomique. Dans le cas d'un ion négatif, il y a moins de protons que d'électrons.