En chimie, électrons de valence sont les électrons situés dans la couche d'électrons la plus externe d'un élément. Savoir comment trouver le nombre d'électrons de valence dans un atome particulier est une compétence importante pour les chimistes car cette information détermine les types de liaisons chimiques qu'elle peut former et, par conséquent, la réactivité de l'élément. Heureusement, tout ce dont vous avez besoin pour trouver les électrons de valence d'un élément est un tableau périodique standard des éléments.
Première partie de deux:
Recherche d'électrons de valence avec un tableau périodique
Métaux sans transition
-
 1 Trouvez un tableau périodique des éléments. Il s’agit d’un tableau à code couleur composé de nombreux carrés qui énumèrent tous les éléments chimiques connus de l’humanité. Le tableau périodique révèle de nombreuses informations sur les éléments. Nous utiliserons certaines de ces informations pour déterminer le nombre d'électrons de valence dans l'atome étudié. Vous pouvez généralement les trouver dans la couverture des manuels de chimie. Il existe également un excellent tableau interactif disponible en ligne ici.[1]
1 Trouvez un tableau périodique des éléments. Il s’agit d’un tableau à code couleur composé de nombreux carrés qui énumèrent tous les éléments chimiques connus de l’humanité. Le tableau périodique révèle de nombreuses informations sur les éléments. Nous utiliserons certaines de ces informations pour déterminer le nombre d'électrons de valence dans l'atome étudié. Vous pouvez généralement les trouver dans la couverture des manuels de chimie. Il existe également un excellent tableau interactif disponible en ligne ici.[1] -
 2 Étiquetez chaque colonne du tableau périodique des éléments de 1 à 18. Généralement, sur un tableau périodique, tous les éléments d'une même colonne verticale auront le même nombre d'électrons de valence. Si votre tableau périodique ne contient pas déjà chaque colonne, donnez à chacun un numéro commençant par 1 pour l'extrémité la plus à gauche et 18 pour l'extrémité la plus à droite. En termes scientifiques, ces colonnes sont appelées l'élément "groupes."[2]
2 Étiquetez chaque colonne du tableau périodique des éléments de 1 à 18. Généralement, sur un tableau périodique, tous les éléments d'une même colonne verticale auront le même nombre d'électrons de valence. Si votre tableau périodique ne contient pas déjà chaque colonne, donnez à chacun un numéro commençant par 1 pour l'extrémité la plus à gauche et 18 pour l'extrémité la plus à droite. En termes scientifiques, ces colonnes sont appelées l'élément "groupes."[2] - Par exemple, si nous travaillions avec un tableau périodique où les groupes ne sont pas numérotés, nous écririons un 1 au-dessus de l’hydrogène (H), un 2 au-dessus du béryllium (Be), et ainsi de suite .
-
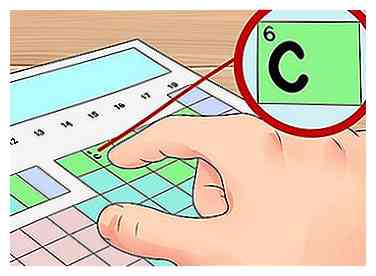 3 Trouvez votre élément sur la table. Maintenant, localisez l'élément pour lequel vous voulez trouver les électrons de valence sur la table. Vous pouvez le faire avec son symbole chimique (les lettres dans chaque case), son numéro atomique (le nombre en haut à gauche de chaque case) ou toute autre information disponible sur la table.
3 Trouvez votre élément sur la table. Maintenant, localisez l'élément pour lequel vous voulez trouver les électrons de valence sur la table. Vous pouvez le faire avec son symbole chimique (les lettres dans chaque case), son numéro atomique (le nombre en haut à gauche de chaque case) ou toute autre information disponible sur la table. - Par exemple, trouvons les électrons de valence pour un élément très commun: carbone (C). Cet élément a un numéro atomique de 6. Il est situé en haut du groupe 14. Dans l'étape suivante, nous trouverons ses électrons de valence.
- Dans cette sous-section, nous allons ignorer les métaux de transition, qui sont les éléments du bloc en forme de rectangle créés par les groupes 3 à 12. Ces éléments sont un peu différents des autres, donc les étapes de cette sous-section ont gagné. t travailler dessus. Voir comment les traiter dans la sous-section ci-dessous.
-
 4 Utilisez les numéros de groupe pour déterminer le nombre d'électrons de valence. Le numéro de groupe d'un métal non de transition peut être utilisé pour trouver le nombre d'électrons de valence dans un atome de cet élément. le les lieux du numéro de groupe est le nombre d'électrons de valence dans un atome de ces éléments. En d'autres termes:
4 Utilisez les numéros de groupe pour déterminer le nombre d'électrons de valence. Le numéro de groupe d'un métal non de transition peut être utilisé pour trouver le nombre d'électrons de valence dans un atome de cet élément. le les lieux du numéro de groupe est le nombre d'électrons de valence dans un atome de ces éléments. En d'autres termes: - Groupe 1: 1 électron de valence
- Groupe 2: 2 électrons de valence
- Groupe 13: 3 électrons de valence
- Groupe 14: 4 électrons de valence
- Groupe 15: 5 électrons de valence
- Groupe 16: 6 électrons de valence
- Groupe 17: 7 électrons de valence
- Groupe 18: 8 électrons de valence (sauf pour l'hélium, qui en a 2)
- Dans notre exemple, le carbone étant dans le groupe 14, on peut dire qu’un atome de carbone a quatre électrons de valence.
Métaux de transition
-
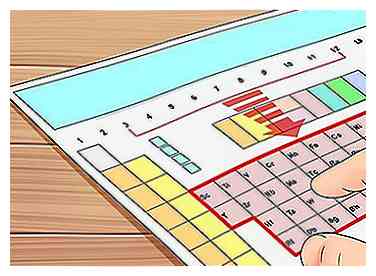 1 Recherchez un élément des groupes 3 à 12. Comme noté ci-dessus, les éléments des groupes 3 à 12 sont appelés "métaux de transition" et se comportent différemment des autres éléments en ce qui concerne les électrons de valence. Dans cette section, nous expliquons comment, dans une certaine mesure, il est souvent impossible d'attribuer des électrons de valence à ces atomes.
1 Recherchez un élément des groupes 3 à 12. Comme noté ci-dessus, les éléments des groupes 3 à 12 sont appelés "métaux de transition" et se comportent différemment des autres éléments en ce qui concerne les électrons de valence. Dans cette section, nous expliquons comment, dans une certaine mesure, il est souvent impossible d'attribuer des électrons de valence à ces atomes. - Par exemple, choisissons le tantale (Ta), élément 73. Dans les prochaines étapes, nous trouverons ses électrons de valence (ou, au moins, essayer à.)
- Notez que les métaux de transition comprennent les séries des lanthanides et des actinides (également appelées "métaux des terres rares") - les deux rangées d'éléments qui sont généralement placées sous le reste du tableau et qui commencent par le lanthane et l'actinium. Ces éléments appartiennent tous à groupe 3 du tableau périodique.
-
 2 Comprenez que les métaux de transition n'ont pas d'électrons de valence «traditionnels». Comprendre pourquoi les métaux de transition ne "fonctionnent" pas vraiment comme le reste du tableau périodique nécessite une petite explication du comportement des électrons dans les atomes. Voir ci-dessous pour un aperçu rapide ou passer cette étape pour obtenir les réponses.[3]
2 Comprenez que les métaux de transition n'ont pas d'électrons de valence «traditionnels». Comprendre pourquoi les métaux de transition ne "fonctionnent" pas vraiment comme le reste du tableau périodique nécessite une petite explication du comportement des électrons dans les atomes. Voir ci-dessous pour un aperçu rapide ou passer cette étape pour obtenir les réponses.[3] - Lorsque les électrons sont ajoutés à un atome, ils sont triés en différentes "orbitales" - essentiellement différentes zones autour du noyau dans lequel les électrons se rassemblent. Généralement, les électrons de valence sont les électrons de la couche externe - en d'autres termes, les derniers électrons ajoutés .
- Pour des raisons un peu trop complexes à expliquer ici, lorsque des électrons sont ajoutés à l’extérieur ré coquille d'un métal de transition (plus en détail ci-dessous), les premiers électrons qui entrent dans la coquille ont tendance à agir comme des électrons de valence normaux, mais après cela, les électrons d'autres couches orbitales agissent parfois comme des électrons de valence. Cela signifie qu'un atome peut avoir plusieurs nombres d'électrons de valence en fonction de la manière dont il est manipulé.
- Pour une explication plus détaillée, voir l'excellente page électronique de valence de Clackamas Community College.[4]
-
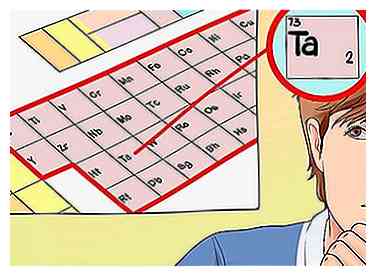 3 Déterminer le nombre d'électrons de valence en fonction du numéro de groupe. Encore une fois, le numéro de groupe de l'élément que vous examinez peut vous indiquer ses électrons de valence. Cependant, pour les métaux de transition, il n'y a pas de modèle que vous pouvez suivre - le numéro de groupe correspondra généralement à une plage de nombres possibles d'électrons de valence.Ceux-ci sont:[5]
3 Déterminer le nombre d'électrons de valence en fonction du numéro de groupe. Encore une fois, le numéro de groupe de l'élément que vous examinez peut vous indiquer ses électrons de valence. Cependant, pour les métaux de transition, il n'y a pas de modèle que vous pouvez suivre - le numéro de groupe correspondra généralement à une plage de nombres possibles d'électrons de valence.Ceux-ci sont:[5] - Groupe 3: 3 électrons de valence
- Groupe 4: 2 à 4 électrons de valence
- Groupe 5: 2 à 5 électrons de valence
- Groupe 6: 2 à 6 électrons de valence
- Groupe 7: 2 à 7 électrons de valence
- Groupe 8: 2 ou 3 électrons de valence
- Groupe 9: 2 ou 3 électrons de valence
- Groupe 10: 2 ou 3 électrons de valence
- Groupe 11: 1 ou 2 électrons de valence
- Groupe 12: 2 électrons de valence
- Dans notre exemple, puisque le tantale est dans le groupe 5, on peut dire qu'il a entre deux et cinq électrons de valence, Dépendant de la situation.
Deuxième partie de deux:
Recherche d'électrons de Valence avec une configuration électronique
-
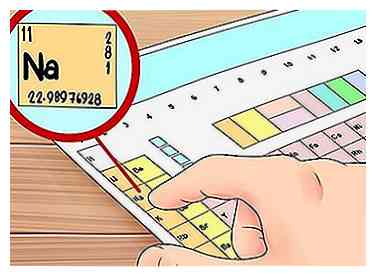 1 Apprenez à lire une configuration électronique. Une autre façon de trouver les électrons de valence d'un élément consiste à utiliser une configuration électronique. Celles-ci peuvent sembler compliquées au début, mais elles ne sont qu'un moyen de représenter les orbitales d'électrons dans un atome avec des lettres et des chiffres et elles sont faciles une fois que vous savez ce que vous regardez.
1 Apprenez à lire une configuration électronique. Une autre façon de trouver les électrons de valence d'un élément consiste à utiliser une configuration électronique. Celles-ci peuvent sembler compliquées au début, mais elles ne sont qu'un moyen de représenter les orbitales d'électrons dans un atome avec des lettres et des chiffres et elles sont faciles une fois que vous savez ce que vous regardez. - Regardons un exemple de configuration pour l'élément sodium (Na):
-
- 1s22s22p63s1
-
- Notez que cette configuration électronique est juste une chaîne répétée qui va comme ceci:
-
- (numéro) (lettre)(numéro augmenté)(numéro) (lettre)(numéro augmenté)…
-
- … etc. le (numéro) (lettre) chunk est le nom de l'orbitale électronique et de la (numéro augmenté) est le nombre d'électrons dans cette orbitale - c'est tout!
- Donc, pour notre exemple, nous dirions que le sodium a 2 électrons dans l'orbite 1s plus 2 électrons dans l'orbitale 2s plus 6 électrons dans l'orbitale 2p plus 1 électron dans l'orbitale 3s. C'est 11 électrons au total - le sodium est l'élément numéro 11, donc c'est logique.
- Gardez à l'esprit que chaque sous-couche a une certaine capacité électronique. Leurs capacités électroniques sont les suivantes:
- s: capacité de 2 électrons
- p: capacité de 6 électrons
- d: capacité de 10 électrons
- f: capacité de 14 électrons
- Regardons un exemple de configuration pour l'élément sodium (Na):
-
 2 Trouvez la configuration électronique de l'élément que vous examinez. Une fois que vous connaissez la configuration électronique d'un élément, trouver son nombre d'électrons de valence est assez simple (sauf, bien sûr, pour les métaux de transition). Si vous êtes configuré dès le départ, vous pouvez passer à l'étape suivante. Si vous devez le trouver vous-même, voir ci-dessous:
2 Trouvez la configuration électronique de l'élément que vous examinez. Une fois que vous connaissez la configuration électronique d'un élément, trouver son nombre d'électrons de valence est assez simple (sauf, bien sûr, pour les métaux de transition). Si vous êtes configuré dès le départ, vous pouvez passer à l'étape suivante. Si vous devez le trouver vous-même, voir ci-dessous: - Examiner la configuration électronique complète pour oganesson (Og), élément 118, qui est le dernier élément du tableau périodique. Il possède le plus d'électrons de tous les éléments, sa configuration électronique démontre donc toutes les possibilités que vous pourriez rencontrer dans d'autres éléments:
-
- 1s22s22p63s23p64s23d104p65s24d105p66s24 f145d106p67s25f146d107p6
-
- Maintenant que vous avez ceci, tout ce que vous devez faire pour trouver la configuration électronique d'un autre atome est juste de remplir ce modèle du début jusqu'à ce que vous n'ayez plus d'électrons. C'est plus facile que ça en a l'air. Par exemple, si nous voulons faire le diagramme orbital pour le chlore (Cl), élément 17, qui a 17 électrons, nous le ferions comme ceci:
-
- 1s22s22p63s23p5
-
- Notez que le nombre d'électrons s'élève à 17: 2 + 2 + 6 + 2 + 5 = 17. Il suffit de changer le nombre dans l'orbitale finale - le reste est le même puisque les orbitales avant la finale sont complètement remplies .
- Pour plus d'informations sur les configurations électroniques, voir également cet article.
- Examiner la configuration électronique complète pour oganesson (Og), élément 118, qui est le dernier élément du tableau périodique. Il possède le plus d'électrons de tous les éléments, sa configuration électronique démontre donc toutes les possibilités que vous pourriez rencontrer dans d'autres éléments:
-
 3 Attribuer des électrons aux coquilles orbitales avec la règle d'octet. Comme les électrons sont ajoutés à un atome, ils tombent dans diverses orbitales selon l'ordre donné ci-dessus - les deux premiers vont dans l'orbitale 1s, les deux suivants vont dans l'orbitale 2s, les six suivants vont dans l'orbitale 2p, et bientôt. Lorsque nous traitons avec des atomes en dehors des métaux de transition, nous disons que ces orbitales forment des "coquilles orbitales" autour du noyau, chaque coquille successive étant plus éloignée que celles du précédent. En plus de la toute première coque, qui ne peut contenir que deux électrons, chaque coque peut avoir huit électrons (sauf, encore une fois, lorsqu'il s'agit de métaux de transition). Règle de l'octet.
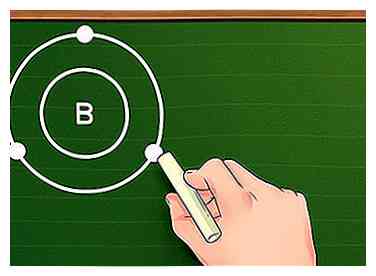
3 Attribuer des électrons aux coquilles orbitales avec la règle d'octet. Comme les électrons sont ajoutés à un atome, ils tombent dans diverses orbitales selon l'ordre donné ci-dessus - les deux premiers vont dans l'orbitale 1s, les deux suivants vont dans l'orbitale 2s, les six suivants vont dans l'orbitale 2p, et bientôt. Lorsque nous traitons avec des atomes en dehors des métaux de transition, nous disons que ces orbitales forment des "coquilles orbitales" autour du noyau, chaque coquille successive étant plus éloignée que celles du précédent. En plus de la toute première coque, qui ne peut contenir que deux électrons, chaque coque peut avoir huit électrons (sauf, encore une fois, lorsqu'il s'agit de métaux de transition). Règle de l'octet. - Par exemple, supposons que nous examinions l'élément Boron (B). Comme son numéro atomique est cinq, on sait qu'il a cinq électrons et sa configuration électronique ressemble à ceci: 1s22s22p1. Comme la première coquille orbitale n'a que deux électrons, nous savons que le bore a deux coquilles: une avec deux électrons 1s et une avec trois électrons des orbitales 2s et 2p.
- Comme autre exemple, un élément comme le chlore (1s22s22p63s23p5) aura trois coquilles orbitales: une avec deux électrons 1s, une avec deux électrons 2s et six électrons 2p, et une avec deux électrons 3s et cinq électrons 3p.
-
 4 Trouvez le nombre d'électrons dans le shell le plus externe. Maintenant que vous connaissez les coques électroniques de votre élément, il est facile de trouver les électrons de valence: utilisez simplement le nombre d'électrons dans la coque la plus extérieure. Si l'enveloppe extérieure est pleine (autrement dit, si elle a huit électrons ou, pour la première, deux), l'élément est inerte et ne réagira pas facilement avec d'autres éléments. Encore une fois, cependant, les règles ne respectent pas toutes ces règles pour les métaux de transition.
4 Trouvez le nombre d'électrons dans le shell le plus externe. Maintenant que vous connaissez les coques électroniques de votre élément, il est facile de trouver les électrons de valence: utilisez simplement le nombre d'électrons dans la coque la plus extérieure. Si l'enveloppe extérieure est pleine (autrement dit, si elle a huit électrons ou, pour la première, deux), l'élément est inerte et ne réagira pas facilement avec d'autres éléments. Encore une fois, cependant, les règles ne respectent pas toutes ces règles pour les métaux de transition. - Par exemple, si nous travaillons avec du bore, comme il y a trois électrons dans le second shell, nous pouvons dire que le bore a Trois électrons de valence.
-
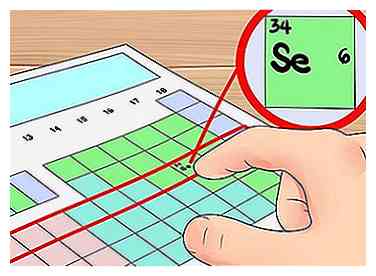 5 Utilisez les lignes du tableau comme raccourcis orbital. Les lignes horizontales du tableau périodique sont appelées l'élément "périodes" En partant du haut du tableau, chaque période correspond au nombre de coquilles d'électrons les atomes dans la période possèdent.Vous pouvez l'utiliser comme raccourci pour déterminer le nombre d'électrons de valence d'un élément. Il suffit de commencer par le côté gauche de sa période pour compter les électrons. Encore une fois, vous voudrez ignorer les métaux de transition avec cette méthode, qui comprend les groupes 3 à 12.
5 Utilisez les lignes du tableau comme raccourcis orbital. Les lignes horizontales du tableau périodique sont appelées l'élément "périodes" En partant du haut du tableau, chaque période correspond au nombre de coquilles d'électrons les atomes dans la période possèdent.Vous pouvez l'utiliser comme raccourci pour déterminer le nombre d'électrons de valence d'un élément. Il suffit de commencer par le côté gauche de sa période pour compter les électrons. Encore une fois, vous voudrez ignorer les métaux de transition avec cette méthode, qui comprend les groupes 3 à 12. - Par exemple, nous savons que l'élément sélénium a quatre coquilles orbitales, car il est dans la quatrième période. Comme il s’agit du sixième élément de gauche à la quatrième période (en ignorant les métaux de transition), nous savons que la quatrième coquille externe a six électrons et que, par conséquent, le sélénium a six électrons de valence.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Trouvez un tableau périodique des éléments. Il s’agit d’un tableau à code couleur composé de nombreux carrés qui énumèrent tous les éléments chimiques connus de l’humanité. Le tableau périodique révèle de nombreuses informations sur les éléments. Nous utiliserons certaines de ces informations pour déterminer le nombre d'électrons de valence dans l'atome étudié. Vous pouvez généralement les trouver dans la couverture des manuels de chimie. Il existe également un excellent tableau interactif disponible en ligne ici.[1]
1 Trouvez un tableau périodique des éléments. Il s’agit d’un tableau à code couleur composé de nombreux carrés qui énumèrent tous les éléments chimiques connus de l’humanité. Le tableau périodique révèle de nombreuses informations sur les éléments. Nous utiliserons certaines de ces informations pour déterminer le nombre d'électrons de valence dans l'atome étudié. Vous pouvez généralement les trouver dans la couverture des manuels de chimie. Il existe également un excellent tableau interactif disponible en ligne ici.[1]  2 Étiquetez chaque colonne du tableau périodique des éléments de 1 à 18. Généralement, sur un tableau périodique, tous les éléments d'une même colonne verticale auront le même nombre d'électrons de valence. Si votre tableau périodique ne contient pas déjà chaque colonne, donnez à chacun un numéro commençant par 1 pour l'extrémité la plus à gauche et 18 pour l'extrémité la plus à droite. En termes scientifiques, ces colonnes sont appelées l'élément "groupes."[2]
2 Étiquetez chaque colonne du tableau périodique des éléments de 1 à 18. Généralement, sur un tableau périodique, tous les éléments d'une même colonne verticale auront le même nombre d'électrons de valence. Si votre tableau périodique ne contient pas déjà chaque colonne, donnez à chacun un numéro commençant par 1 pour l'extrémité la plus à gauche et 18 pour l'extrémité la plus à droite. En termes scientifiques, ces colonnes sont appelées l'élément "groupes."[2]  3 Trouvez votre élément sur la table. Maintenant, localisez l'élément pour lequel vous voulez trouver les électrons de valence sur la table. Vous pouvez le faire avec son symbole chimique (les lettres dans chaque case), son numéro atomique (le nombre en haut à gauche de chaque case) ou toute autre information disponible sur la table.
3 Trouvez votre élément sur la table. Maintenant, localisez l'élément pour lequel vous voulez trouver les électrons de valence sur la table. Vous pouvez le faire avec son symbole chimique (les lettres dans chaque case), son numéro atomique (le nombre en haut à gauche de chaque case) ou toute autre information disponible sur la table.  4 Utilisez les numéros de groupe pour déterminer le nombre d'électrons de valence. Le numéro de groupe d'un métal non de transition peut être utilisé pour trouver le nombre d'électrons de valence dans un atome de cet élément. le les lieux du numéro de groupe est le nombre d'électrons de valence dans un atome de ces éléments. En d'autres termes:
4 Utilisez les numéros de groupe pour déterminer le nombre d'électrons de valence. Le numéro de groupe d'un métal non de transition peut être utilisé pour trouver le nombre d'électrons de valence dans un atome de cet élément. le les lieux du numéro de groupe est le nombre d'électrons de valence dans un atome de ces éléments. En d'autres termes:  1 Recherchez un élément des groupes 3 à 12. Comme noté ci-dessus, les éléments des groupes 3 à 12 sont appelés "métaux de transition" et se comportent différemment des autres éléments en ce qui concerne les électrons de valence. Dans cette section, nous expliquons comment, dans une certaine mesure, il est souvent impossible d'attribuer des électrons de valence à ces atomes.
1 Recherchez un élément des groupes 3 à 12. Comme noté ci-dessus, les éléments des groupes 3 à 12 sont appelés "métaux de transition" et se comportent différemment des autres éléments en ce qui concerne les électrons de valence. Dans cette section, nous expliquons comment, dans une certaine mesure, il est souvent impossible d'attribuer des électrons de valence à ces atomes.  2 Comprenez que les métaux de transition n'ont pas d'électrons de valence «traditionnels». Comprendre pourquoi les métaux de transition ne "fonctionnent" pas vraiment comme le reste du tableau périodique nécessite une petite explication du comportement des électrons dans les atomes. Voir ci-dessous pour un aperçu rapide ou passer cette étape pour obtenir les réponses.[3]
2 Comprenez que les métaux de transition n'ont pas d'électrons de valence «traditionnels». Comprendre pourquoi les métaux de transition ne "fonctionnent" pas vraiment comme le reste du tableau périodique nécessite une petite explication du comportement des électrons dans les atomes. Voir ci-dessous pour un aperçu rapide ou passer cette étape pour obtenir les réponses.[3]  3 Déterminer le nombre d'électrons de valence en fonction du numéro de groupe. Encore une fois, le numéro de groupe de l'élément que vous examinez peut vous indiquer ses électrons de valence. Cependant, pour les métaux de transition, il n'y a pas de modèle que vous pouvez suivre - le numéro de groupe correspondra généralement à une plage de nombres possibles d'électrons de valence.Ceux-ci sont:[5]
3 Déterminer le nombre d'électrons de valence en fonction du numéro de groupe. Encore une fois, le numéro de groupe de l'élément que vous examinez peut vous indiquer ses électrons de valence. Cependant, pour les métaux de transition, il n'y a pas de modèle que vous pouvez suivre - le numéro de groupe correspondra généralement à une plage de nombres possibles d'électrons de valence.Ceux-ci sont:[5]  1 Apprenez à lire une configuration électronique. Une autre façon de trouver les électrons de valence d'un élément consiste à utiliser une configuration électronique. Celles-ci peuvent sembler compliquées au début, mais elles ne sont qu'un moyen de représenter les orbitales d'électrons dans un atome avec des lettres et des chiffres et elles sont faciles une fois que vous savez ce que vous regardez.
1 Apprenez à lire une configuration électronique. Une autre façon de trouver les électrons de valence d'un élément consiste à utiliser une configuration électronique. Celles-ci peuvent sembler compliquées au début, mais elles ne sont qu'un moyen de représenter les orbitales d'électrons dans un atome avec des lettres et des chiffres et elles sont faciles une fois que vous savez ce que vous regardez.  2 Trouvez la configuration électronique de l'élément que vous examinez. Une fois que vous connaissez la configuration électronique d'un élément, trouver son nombre d'électrons de valence est assez simple (sauf, bien sûr, pour les métaux de transition). Si vous êtes configuré dès le départ, vous pouvez passer à l'étape suivante. Si vous devez le trouver vous-même, voir ci-dessous:
2 Trouvez la configuration électronique de l'élément que vous examinez. Une fois que vous connaissez la configuration électronique d'un élément, trouver son nombre d'électrons de valence est assez simple (sauf, bien sûr, pour les métaux de transition). Si vous êtes configuré dès le départ, vous pouvez passer à l'étape suivante. Si vous devez le trouver vous-même, voir ci-dessous:  3 Attribuer des électrons aux coquilles orbitales avec la règle d'octet. Comme les électrons sont ajoutés à un atome, ils tombent dans diverses orbitales selon l'ordre donné ci-dessus - les deux premiers vont dans l'orbitale 1s, les deux suivants vont dans l'orbitale 2s, les six suivants vont dans l'orbitale 2p, et bientôt. Lorsque nous traitons avec des atomes en dehors des métaux de transition, nous disons que ces orbitales forment des "coquilles orbitales" autour du noyau, chaque coquille successive étant plus éloignée que celles du précédent. En plus de la toute première coque, qui ne peut contenir que deux électrons, chaque coque peut avoir huit électrons (sauf, encore une fois, lorsqu'il s'agit de métaux de transition). Règle de l'octet.
3 Attribuer des électrons aux coquilles orbitales avec la règle d'octet. Comme les électrons sont ajoutés à un atome, ils tombent dans diverses orbitales selon l'ordre donné ci-dessus - les deux premiers vont dans l'orbitale 1s, les deux suivants vont dans l'orbitale 2s, les six suivants vont dans l'orbitale 2p, et bientôt. Lorsque nous traitons avec des atomes en dehors des métaux de transition, nous disons que ces orbitales forment des "coquilles orbitales" autour du noyau, chaque coquille successive étant plus éloignée que celles du précédent. En plus de la toute première coque, qui ne peut contenir que deux électrons, chaque coque peut avoir huit électrons (sauf, encore une fois, lorsqu'il s'agit de métaux de transition). Règle de l'octet.  4 Trouvez le nombre d'électrons dans le shell le plus externe. Maintenant que vous connaissez les coques électroniques de votre élément, il est facile de trouver les électrons de valence: utilisez simplement le nombre d'électrons dans la coque la plus extérieure. Si l'enveloppe extérieure est pleine (autrement dit, si elle a huit électrons ou, pour la première, deux), l'élément est inerte et ne réagira pas facilement avec d'autres éléments. Encore une fois, cependant, les règles ne respectent pas toutes ces règles pour les métaux de transition.
4 Trouvez le nombre d'électrons dans le shell le plus externe. Maintenant que vous connaissez les coques électroniques de votre élément, il est facile de trouver les électrons de valence: utilisez simplement le nombre d'électrons dans la coque la plus extérieure. Si l'enveloppe extérieure est pleine (autrement dit, si elle a huit électrons ou, pour la première, deux), l'élément est inerte et ne réagira pas facilement avec d'autres éléments. Encore une fois, cependant, les règles ne respectent pas toutes ces règles pour les métaux de transition.  5 Utilisez les lignes du tableau comme raccourcis orbital. Les lignes horizontales du tableau périodique sont appelées l'élément "périodes" En partant du haut du tableau, chaque période correspond au nombre de coquilles d'électrons les atomes dans la période possèdent.Vous pouvez l'utiliser comme raccourci pour déterminer le nombre d'électrons de valence d'un élément. Il suffit de commencer par le côté gauche de sa période pour compter les électrons. Encore une fois, vous voudrez ignorer les métaux de transition avec cette méthode, qui comprend les groupes 3 à 12.
5 Utilisez les lignes du tableau comme raccourcis orbital. Les lignes horizontales du tableau périodique sont appelées l'élément "périodes" En partant du haut du tableau, chaque période correspond au nombre de coquilles d'électrons les atomes dans la période possèdent.Vous pouvez l'utiliser comme raccourci pour déterminer le nombre d'électrons de valence d'un élément. Il suffit de commencer par le côté gauche de sa période pour compter les électrons. Encore une fois, vous voudrez ignorer les métaux de transition avec cette méthode, qui comprend les groupes 3 à 12.