La réussite d'un cours de chimie générale exige une bonne compréhension des principes fondamentaux, la capacité de faire des mathématiques de base, une calculatrice pour des équations plus avancées et la volonté d'acquérir des connaissances sur un sujet complexe. La chimie est l'étude de la matière et de ses propriétés. Tout ce qui vous entoure implique la chimie. Même des choses simples que vous pouvez prendre pour acquises, comme l'eau que vous buvez et l'air que vous respirez. Gardez l'esprit ouvert lorsque vous apprenez ce qui se passe autour de vous, jusqu'au niveau atomique. Votre première exposition à la chimie peut être difficile et passionnante.
Première partie de huit:
Comprendre les structures atomiques
-
 1 Commencez par les structures les plus élémentaires. Pour réussir votre cours de chimie, vous devrez bien comprendre les éléments constitutifs de tout ce qui a une substance ou une masse.
1 Commencez par les structures les plus élémentaires. Pour réussir votre cours de chimie, vous devrez bien comprendre les éléments constitutifs de tout ce qui a une substance ou une masse. - L'atome est l'endroit où la chimie commence. Tout dans la classe sera une extension, construite sur cette information de base. Assurez-vous de prendre le temps de comprendre le matériel présenté sur les atomes.
-
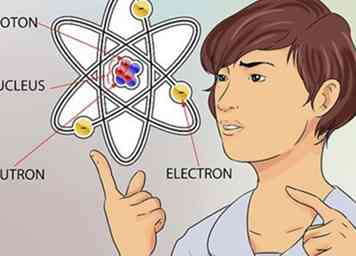 2 Saisir le concept d'un atome. Un atome est considéré comme le plus petit élément constitutif de tout ce qui a une masse, y compris des choses que nous ne pouvons pas toujours voir, comme les gaz. Mais même le minuscule atome possède des parties encore plus petites qui constituent sa structure.[1]
2 Saisir le concept d'un atome. Un atome est considéré comme le plus petit élément constitutif de tout ce qui a une masse, y compris des choses que nous ne pouvons pas toujours voir, comme les gaz. Mais même le minuscule atome possède des parties encore plus petites qui constituent sa structure.[1] - Un atome est composé de 3 parties. Ces parties sont des neutrons, des protons et des électrons. Le centre de l'atome s'appelle le noyau. Le noyau est constitué de neutrons et de protons. Les électrons sont les particules qui flottent autour de la partie extérieure de l'atome, comme les planètes qui tournent autour du soleil.[2]
- La taille d'un atome est incroyablement petite. Pour vous donner une idée, pensez à la plus grande salle de sport que vous connaissez, peut-être l’astrodome de Houston. Si vous considérez que l'Astrodome est l'atome, alors le noyau de cet atome a environ la taille d'un pois, quelque part autour de la ligne des 50 mètres.[3]
-
 3 Comprendre le cadre atomique d'un élément. Un élément est considéré comme une substance dans la nature qui ne peut être décomposée en aucun autre élément ou sous une forme plus simple. Les éléments sont constitués d'atomes.[4]
3 Comprendre le cadre atomique d'un élément. Un élément est considéré comme une substance dans la nature qui ne peut être décomposée en aucun autre élément ou sous une forme plus simple. Les éléments sont constitués d'atomes.[4] - Les atomes d'un élément spécifique sont toujours les mêmes. Cela signifie que chaque élément a un nombre connu et unique de neutrons et de protons dans sa structure atomique.[5]
-
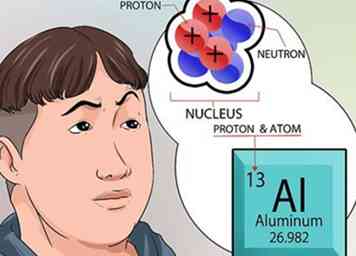 4 Comprendre plus sur le noyau. Les neutrons, trouvés dans le noyau, ont une charge neutre. Les protons ont une charge positive. Le numéro atomique d'un élément est exactement le même que le nombre de protons contenus dans le noyau.[6]
4 Comprendre plus sur le noyau. Les neutrons, trouvés dans le noyau, ont une charge neutre. Les protons ont une charge positive. Le numéro atomique d'un élément est exactement le même que le nombre de protons contenus dans le noyau.[6] - Vous n'avez rien à calculer pour connaître le nombre de protons dans le noyau d'un élément. Ce nombre est imprimé en haut de chaque case au carré, pour chaque élément, dans le tableau périodique.
-
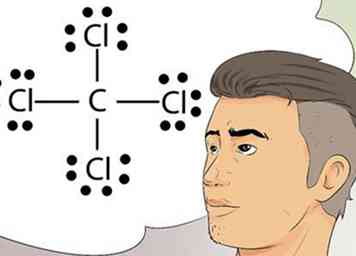 5 Reconnaître les diagrammes de Lewis. Les diagrammes de Lewis sont parfois appelés diagrammes électron-point. Ce sont des diagrammes simples qui utilisent des points pour représenter les électrons appariés et non appariés dans la couche externe d'un atome.[7]
5 Reconnaître les diagrammes de Lewis. Les diagrammes de Lewis sont parfois appelés diagrammes électron-point. Ce sont des diagrammes simples qui utilisent des points pour représenter les électrons appariés et non appariés dans la couche externe d'un atome.[7] - Les structures de Lewis sont utiles pour dessiner des diagrammes simples qui identifient les liaisons, telles que les liaisons covalentes, qui sont partagées entre les éléments d'un atome ou d'une molécule.[8]
-
 6 Savoir ce que signifie la règle d'octet. Les diagrammes de Lewis opèrent sur la règle des octets, qui stipule que les atomes sont stables quand ils ont accès à huit électrons dans la coque externe. L'hydrogène est l'exception et est considéré comme stable avec deux électrons dans la coque externe.[9]
6 Savoir ce que signifie la règle d'octet. Les diagrammes de Lewis opèrent sur la règle des octets, qui stipule que les atomes sont stables quand ils ont accès à huit électrons dans la coque externe. L'hydrogène est l'exception et est considéré comme stable avec deux électrons dans la coque externe.[9] -
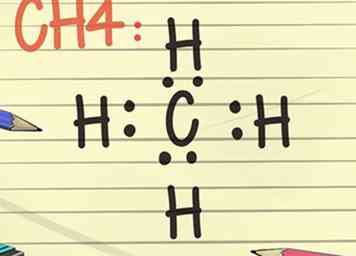 7 Dessine un diagramme de Lewis. Le symbole d'un élément, entouré d'un arrangement de points, est un diagramme de Lewis. Considérez le diagramme comme une image fixe d’un film. Au lieu que les électrons tournoient autour de l'extérieur de l'élément, ils sont représentés comme un moment fixe dans le temps.[10]
7 Dessine un diagramme de Lewis. Le symbole d'un élément, entouré d'un arrangement de points, est un diagramme de Lewis. Considérez le diagramme comme une image fixe d’un film. Au lieu que les électrons tournoient autour de l'extérieur de l'élément, ils sont représentés comme un moment fixe dans le temps.[10] - Le diagramme montre la disposition stable des électrons, où ils sont liés à l'élément suivant, et des informations sur la force des liaisons, comme si les liaisons étaient partagées ou doublées.
- Pensez à la règle de l'octet et visualisez le symbole d'un élément, peut-être C pour le carbone. Maintenant, placez ou imaginez 2 points à chaque position de la boussole, soit 2 points au nord du C, à l'est, à l'ouest et au sud. Imaginez maintenant un H, représentant un atome d'hydrogène de l'autre côté de chacun des 2 points. Ce diagramme de Lewis complété signifie que l'atome de carbone unique au centre est entouré de 4 atomes d'hydrogène. Les électrons sont liés de manière covalente, ce qui signifie que les atomes de carbone et d'hydrogène partagent l'un de leurs électrons pour se lier les uns aux autres.[11]
- La formule moléculaire de cet exemple est le CH4 et est la formule du gaz méthane.
-
 8 Comprendre l'arrangement des électrons comme ils lient des éléments ensemble. Les diagrammes de Lewis sont une représentation visuelle simpliste de ce que l'on comprend des liaisons chimiques.
8 Comprendre l'arrangement des électrons comme ils lient des éléments ensemble. Les diagrammes de Lewis sont une représentation visuelle simpliste de ce que l'on comprend des liaisons chimiques. - Parlez à votre professeur ou aux membres de votre groupe d'étude si les concepts de liaison chimique et de diagramme de Lewis ne sont pas clairs.
Deuxième partie de huit:
Lire et comprendre le tableau périodique
-
 1 Regardez le tableau périodique. Si vous rencontrez des problèmes avec les propriétés des éléments, passez du temps à examiner tout élément disponible dans le tableau périodique. Plus important encore, regardez-en un.
1 Regardez le tableau périodique. Si vous rencontrez des problèmes avec les propriétés des éléments, passez du temps à examiner tout élément disponible dans le tableau périodique. Plus important encore, regardez-en un. - Comprendre le tableau périodique est essentiel pour réussir la première partie de votre cours de chimie.
- 2 Identifiez les éléments du tableau périodique. Le tableau périodique est composé uniquement d'éléments. Chaque élément a un symbole composé d'une ou deux lettres. Ce symbole identifie toujours cet élément. Na, par exemple, signifie toujours le sodium. Le nom complet de l'élément apparaît juste en dessous du symbole.[12]
- 3 Localisez le numéro atomique de chaque élément. Le nombre au-dessus du symbole est le numéro atomique. Le numéro atomique est le même que le nombre de protons trouvés dans le noyau.[13]
-
 4 Trouvez la masse atomique de chaque élément. Le nombre en bas est la masse atomique. Rappelez-vous que le nombre de protons combiné au nombre de neutrons trouvés dans le noyau est égal au nombre de masse atomique.[14]
4 Trouvez la masse atomique de chaque élément. Le nombre en bas est la masse atomique. Rappelez-vous que le nombre de protons combiné au nombre de neutrons trouvés dans le noyau est égal au nombre de masse atomique.[14] -
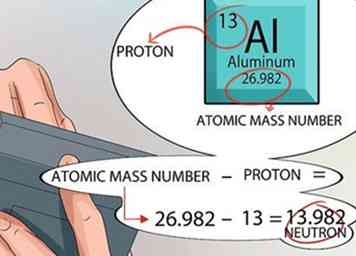 5 Calculez le nombre de neutrons trouvés dans le noyau. Vous pouvez utiliser les chiffres fournis dans le tableau périodique pour le déterminer. Le numéro atomique de tout élément est exactement le même que le nombre de protons trouvés dans le noyau.
5 Calculez le nombre de neutrons trouvés dans le noyau. Vous pouvez utiliser les chiffres fournis dans le tableau périodique pour le déterminer. Le numéro atomique de tout élément est exactement le même que le nombre de protons trouvés dans le noyau. - L'unité de masse atomique est imprimée pour chaque élément à l'intérieur du carré en bas, juste sous le nom de l'élément.
- Rappelez-vous que les deux seules choses qui se trouvent dans le noyau d'un atome sont les protons et les neutrons. Le tableau périodique vous indique le nombre de protons et vous indique le nombre de masse atomique.
- À partir de là, le calcul est simple. Soustrayez le nombre de protons du nombre de masse atomique, et vous obtenez le nombre de neutrons dans le noyau de chaque atome pour cet élément.[15]
-
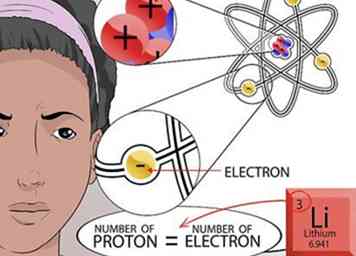 6 Calculez le nombre d'électrons. Rappelez-vous que les contraires attirent. Les électrons sont des particules chargées positivement qui volent autour du noyau d'un atome, comme les planètes qui tournent autour du soleil. Le nombre d'électrons chargés négativement qui sont attirés vers le noyau dépend du nombre de protons chargés positivement situés dans le noyau.
6 Calculez le nombre d'électrons. Rappelez-vous que les contraires attirent. Les électrons sont des particules chargées positivement qui volent autour du noyau d'un atome, comme les planètes qui tournent autour du soleil. Le nombre d'électrons chargés négativement qui sont attirés vers le noyau dépend du nombre de protons chargés positivement situés dans le noyau. - Comme un atome n'a pas de charge globale, toutes les charges positives et négatives contenues dans l'atome doivent être équilibrées. Par conséquent, le nombre d'électrons est égal au nombre de protons.[16]
Troisième partie de huit:
Prédiction des réactions chimiques
-
 1 Équilibrer une équation chimique. Dans un cours de chimie, vous devrez savoir comment prédire ce qui se passera lorsque des éléments sont combinés. Sur le papier, cela s'appelle les équations chimiques d'équilibrage.[17]
1 Équilibrer une équation chimique. Dans un cours de chimie, vous devrez savoir comment prédire ce qui se passera lorsque des éléments sont combinés. Sur le papier, cela s'appelle les équations chimiques d'équilibrage.[17] - Le format d'une équation chimique est constitué de réactifs situés à gauche de l'équation, puis d'une flèche dans la direction des produits de l'équation, puis des produits. Les parties d'un côté de l'équation doivent équilibrer les parties de l'autre.[18]
- Par exemple, Réactif 1 + Réactif 2 → Produit 1 + Produit 2
- Voici un exemple d'utilisation des symboles pour l'étain, qui est Sn, sous sa forme oxydée, qui est SnO2, combiné avec de l'hydrogène gazeux, qui est écrit H2. SnO2 + H2 → Sn + H2O.
- Mais cette équation n'est pas équilibrée car la quantité de réactifs doit être égale à la quantité de produits. Le côté gauche a un atome d'oxygène de plus que le côté droit.[19]
- Utilisez les mathématiques de base pour équilibrer l'équation en indiquant 2 unités d'hydrogène sur le côté gauche de l'équation et 2 molécules d'eau sur la droite. L'équation équilibrée finale ressemble à ceci: SnO2 + 2 H2 → Sn + 2 H2O.[20]
-
 2 Pensez aux équations différemment. Si vous ne parvenez pas à trouver un équilibre entre les équations chimiques, pensez à l’équation dans le cadre d’une recette, mais celle-ci doit être ajustée des deux côtés afin de réduire votre consommation au minimum.
2 Pensez aux équations différemment. Si vous ne parvenez pas à trouver un équilibre entre les équations chimiques, pensez à l’équation dans le cadre d’une recette, mais celle-ci doit être ajustée des deux côtés afin de réduire votre consommation au minimum. - L'équation vous donne les ingrédients, à gauche de l'équation, mais ne vous dit pas combien il faut utiliser pour chaque ingrédient. L'équation vous indique également ce que les produits vont inclure, mais encore une fois ne vous dit pas la quantité de produits. Vous devez comprendre cela.
- Dans l'exemple précédent, SnO2 + H2 → Sn + H2O, expliquez pourquoi cette équation ou formule de recette ne fonctionnera pas. Les parties Sn sont égales des deux côtés et les parties H2 sont égales des deux côtés. Mais le côté gauche a 2 parties d'oxygène et le côté droit a seulement 1 oxygène.
- Changez le côté droit de l’équation pour indiquer que le produit contiendra 2 parties H2O. Le 2 devant le H2O signifie que toutes les quantités de ce groupe sont maintenant doublées. Donc maintenant l'oxygène s'équilibre, mais en ajoutant les 2, il y a plus d'hydrogène sur le côté droit de l'équation que sur la gauche. Revenez à gauche et changez l'ingrédient H2 pour le doubler, en plaçant un 2 devant le H2.
- Vous avez maintenant ajusté les ingrédients des deux côtés de l'équation. Ce qui entre dans la recette et ce qui en sort est égal ou équilibré.
-
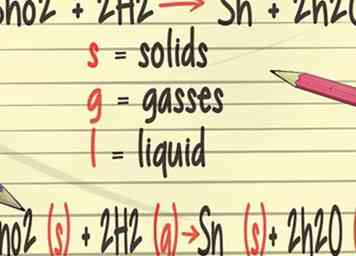 3 Ajoutez plus de détails à vos équations équilibrées. Dans votre cours de chimie, vous apprendrez à ajouter des symboles à vos équations équilibrées qui représentent l'état physique des éléments. Ces symboles incluront (s) pour les solides, (g) pour les gaz et (l) pour les liquides.[21]
3 Ajoutez plus de détails à vos équations équilibrées. Dans votre cours de chimie, vous apprendrez à ajouter des symboles à vos équations équilibrées qui représentent l'état physique des éléments. Ces symboles incluront (s) pour les solides, (g) pour les gaz et (l) pour les liquides.[21] -
 4 Identifier les changements qui surviennent dans une réaction chimique. Les réactions chimiques commencent par les éléments de base, ou des éléments déjà combinés, appelés réactifs. La combinaison de deux réactifs ou plus donne un seul produit ou plusieurs produits.
4 Identifier les changements qui surviennent dans une réaction chimique. Les réactions chimiques commencent par les éléments de base, ou des éléments déjà combinés, appelés réactifs. La combinaison de deux réactifs ou plus donne un seul produit ou plusieurs produits. - Pour passer la chimie, vous devez savoir comment résoudre les équations qui impliquent des réactifs chimiques, des produits et l'introduction d'une autre influence qui altère les réactifs, les produits ou les deux.[22]
Quatrième partie de huit:
Identification des réactions chimiques
-
 1 Reconnaître les types de réactions. De nombreuses influences peuvent entraîner des réactions chimiques, en plus de la simple combinaison d'ingrédients.
1 Reconnaître les types de réactions. De nombreuses influences peuvent entraîner des réactions chimiques, en plus de la simple combinaison d'ingrédients. - Les types courants de réactions chimiques que vous pouvez vous attendre à apprendre comprennent la synthèse, l'analyse, la substitution, le double déplacement, l'acide-base, l'oxydoréduction, la combustion, l'isomérisation et l'hydrolyse.[23]
- Les types de réactions présentés dans votre cours de chimie peuvent varier en fonction des objectifs de chaque classe. La chimie du secondaire peut ne pas fournir le même niveau de détail que celui de la chimie dans un collège ou une université.
-
 2 Utilisez les ressources fournies. Vous devrez saisir les différences dans chaque type de réaction traité dans votre classe. Utilisez les ressources mises à votre disposition par votre enseignant ou professeur pour comprendre les différents types de réactions abordées dans votre classe. N'ayez pas peur de poser des questions.
2 Utilisez les ressources fournies. Vous devrez saisir les différences dans chaque type de réaction traité dans votre classe. Utilisez les ressources mises à votre disposition par votre enseignant ou professeur pour comprendre les différents types de réactions abordées dans votre classe. N'ayez pas peur de poser des questions. - Comprendre les changements qui se produisent avec différents types de réactions chimiques peut être déroutant. Comprendre ce qui se passe lors de réactions chimiques spécifiques peut être une partie difficile de votre cours de chimie.
-
 3 Réfléchissez logiquement aux réactions chimiques. Essayez de ne pas le rendre plus difficile qu’il ne l’est déjà en vous mettant dans la terminologie.Les types de réactions chimiques que vous allez apprendre impliquent simplement de faire quelque chose pour changer quelque chose.
3 Réfléchissez logiquement aux réactions chimiques. Essayez de ne pas le rendre plus difficile qu’il ne l’est déjà en vous mettant dans la terminologie.Les types de réactions chimiques que vous allez apprendre impliquent simplement de faire quelque chose pour changer quelque chose. - Par exemple, vous savez déjà ce qui se passe lorsque vous combinez 2 atomes d’hydrogène avec 1 atome d’oxygène, vous obtenez de l’eau. Donc, si vous mettez cette eau que vous venez de fabriquer dans une casserole et que vous la mettez sur le feu en utilisant la chaleur, quelque chose change. Vous avez créé une réaction chimique. Si vous mettez cette eau dans le congélateur, même chose. Vous avez introduit un changement qui a modifié le réactif d'origine, l'eau dans ce cas.
- Passez en revue chaque type de réaction un par un jusqu'à ce que vous le compreniez, puis passez au type suivant. Concentrez-vous sur la source d'énergie à l'origine de la réaction et sur les principaux changements qui en résultent.
- Si vous éprouvez des difficultés dans ce domaine, faites une liste de ce qui vous embrouille et passez-le en revue avec votre professeur, votre groupe d'étude ou quelqu'un qui connaît bien la chimie.
Cinquième partie de huit:
Utiliser le langage de la chimie
-
 1 Apprenez comment les composés sont nommés. La chimie a ses propres règles de nomenclature. Les types de réactions qui se produisent avec les composés chimiques, la perte ou le gain d'électrons dans leur enveloppe externe et la stabilité ou l'instabilité des composés font partie de la nomenclature chimique.
1 Apprenez comment les composés sont nommés. La chimie a ses propres règles de nomenclature. Les types de réactions qui se produisent avec les composés chimiques, la perte ou le gain d'électrons dans leur enveloppe externe et la stabilité ou l'instabilité des composés font partie de la nomenclature chimique. -
 2 Prenez au sérieux la section sur la nomenclature. La plupart des cours de chimie débutants ont une section consacrée uniquement à la nomenclature. Dans certaines écoles, le fait de ne pas réussir la partie nomenclature de la classe signifie échouer à la classe.
2 Prenez au sérieux la section sur la nomenclature. La plupart des cours de chimie débutants ont une section consacrée uniquement à la nomenclature. Dans certaines écoles, le fait de ne pas réussir la partie nomenclature de la classe signifie échouer à la classe. - Si possible, travaillez sur la nomenclature avant de commencer le cours. De nombreux classeurs sont disponibles à l'achat ou en ligne.
-
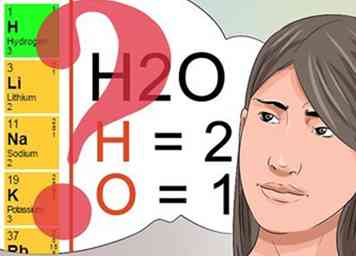 3 Savoir ce que les numéros en exposant et en indice indiquent. Comprendre ce que signifient les chiffres en exposant et en indice sera essentiel pour réussir votre cours de chimie.[24]
3 Savoir ce que les numéros en exposant et en indice indiquent. Comprendre ce que signifient les chiffres en exposant et en indice sera essentiel pour réussir votre cours de chimie.[24] - Les numéros en exposant suivent un modèle trouvé dans le tableau périodique et indiquent la charge globale de l'élément ou du composé chimique. Examinez le tableau périodique pour voir les éléments des lignes verticales qui partagent les mêmes nombres en exposant.
- Les indices sont utilisés pour identifier la quantité de chaque élément identifié faisant partie du composé chimique. Comme indiqué précédemment, l'indice de 2 dans la molécule H2O indique qu'il y a 2 atomes d'hydrogène dans cette molécule.
-
 4 Reconnaître comment les atomes réagissent les uns avec les autres. Une partie de la nomenclature utilisée en chimie implique des règles spécifiques pour nommer les produits à partir de types spécifiques de réactions.[25]
4 Reconnaître comment les atomes réagissent les uns avec les autres. Une partie de la nomenclature utilisée en chimie implique des règles spécifiques pour nommer les produits à partir de types spécifiques de réactions.[25] - L'une de ces réactions est la réaction de réduction oxydative. Cette réaction implique le processus de gagner ou de perdre des électrons.
- Un moyen facile de se souvenir du processus est de se souvenir de la phrase «LEO le lion dit GER». Cela signifie perdre les électrons dans l'oxydation et les électrons de gain dans la réduction.[26]
-
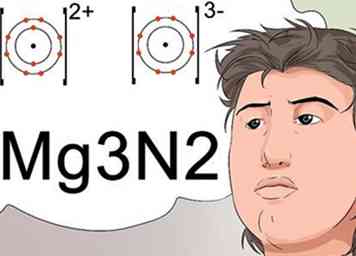 5 Reconnaître que les indices peuvent indiquer la formule pour une charge stable à un composé. Les scientifiques utilisent des indices pour identifier la formule moléculaire finale d'un composé, qui indique également un composé stable avec une charge neutre.
5 Reconnaître que les indices peuvent indiquer la formule pour une charge stable à un composé. Les scientifiques utilisent des indices pour identifier la formule moléculaire finale d'un composé, qui indique également un composé stable avec une charge neutre. - Pour créer une charge neutre, l'ion chargé positivement, appelé cation, doit être équilibré par une charge égale provenant d'un ion négatif, appelé anion. Les accusations sont identifiées comme des exposants.[27]
- Par exemple, l'ion magnésium porte une charge cationique de +2 et l'ion azote a une charge anionique de -3. Les +2 et -3 seraient indiqués comme des exposants. Pour combiner correctement les deux éléments afin d'obtenir une charge neutre, 3 atomes de magnésium sont utilisés pour 2 éléments azotés.[28]
- La nomenclature qui identifie ceci utilise des indices et est écrite sous la forme Mg3N2.[29]
-
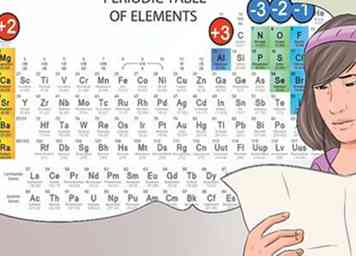 6 Identifier les anions et les cations de leur position sur le tableau périodique. Les éléments du tableau périodique qui se trouvent dans la première colonne d'éléments sont considérés comme des alcalis, et forment des charges de 1 cation. Par exemple Na + et Li +.[30]
6 Identifier les anions et les cations de leur position sur le tableau périodique. Les éléments du tableau périodique qui se trouvent dans la première colonne d'éléments sont considérés comme des alcalis, et forment des charges de 1 cation. Par exemple Na + et Li +.[30] - Les métaux alcalino-terreux présents dans la deuxième colonne forment des cations 2+, tels que Mg2 + et Ba2 +.[31]
- Les éléments de la septième colonne sont appelés halogènes et forment -1 anions, tels que Cl- et I-.[32]
-
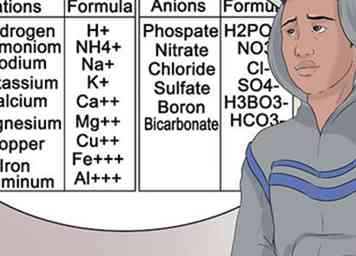 7 Apprenez à reconnaître les anions et les cations les plus communs. Pour vous aider à réussir votre cours de chimie, soyez aussi familier que possible avec la nomenclature associée aux groupes d’éléments. Ce type d'exposant ne change pas.[33]
7 Apprenez à reconnaître les anions et les cations les plus communs. Pour vous aider à réussir votre cours de chimie, soyez aussi familier que possible avec la nomenclature associée aux groupes d’éléments. Ce type d'exposant ne change pas.[33] - En d'autres termes, le magnésium est toujours représenté par Mg et porte toujours une charge cationique de +2.[34]
-
 8 Pensez à la chimie en apprenant une nouvelle langue. Comprenez que les formes écrites d'indication de charges, le nombre d'atomes dans une molécule et les liaisons formées pour maintenir les molécules ensemble font toutes partie du langage de la chimie. Tout cela est une manière écrite de représenter ce qui se passe dans les réactions chimiques qui ne peuvent pas réellement être vues.
8 Pensez à la chimie en apprenant une nouvelle langue. Comprenez que les formes écrites d'indication de charges, le nombre d'atomes dans une molécule et les liaisons formées pour maintenir les molécules ensemble font toutes partie du langage de la chimie. Tout cela est une manière écrite de représenter ce qui se passe dans les réactions chimiques qui ne peuvent pas réellement être vues. - Il serait tellement plus facile de comprendre si tout était visible, juste devant vous. Mais en plus de comprendre toute la chimie qui se passe, vous devez également comprendre le langage utilisé pour enregistrer et représenter tout ce qui concerne la chimie.
- Si comprendre la chimie est difficile pour vous, réalisez que vous n'êtes pas seul, mais ne le laissez pas vous battre. Parlez avec votre professeur, votre groupe d’étude, un assistant pédagogique ou une personne vraiment douée en chimie. Vous pouvez apprendre tout cela, mais cela peut aider si cela peut être expliqué d'une manière qui vous semble logique.
Sixième partie de huit:
Faire les maths
-
 1 Connaître la séquence pour les calculs mathématiques de base. En chimie, des calculs très détaillés sont parfois nécessaires, mais d'autres fois, seules les compétences de base en mathématiques sont suffisantes. Il est important de comprendre la séquence appropriée pour effectuer les calculs dans une équation.[35]
1 Connaître la séquence pour les calculs mathématiques de base. En chimie, des calculs très détaillés sont parfois nécessaires, mais d'autres fois, seules les compétences de base en mathématiques sont suffisantes. Il est important de comprendre la séquence appropriée pour effectuer les calculs dans une équation.[35] - Mémorisez une phrase utile. La phrase «Veuillez excuser ma chère tante Sally» vous indique quelles applications effectuer en premier. La première lettre de chaque mot indique l'ordre à utiliser.Tout ce qui se trouve entre parenthèses se fait en premier, puis Exponentiation, Multiplication ou Division, dernier ajout ou soustraction.
- Complétez le calcul 3 + 2 x 6 = ___, en commandant vos pas selon la phrase. La réponse à l'équation est 15.
-
 2 Soyez à l'aise d'arrondir de très grands nombres. Bien que l'arrondissement des nombres ne soit pas propre à la chimie, les réponses à certaines équations mathématiques complexes entraînent des nombres trop longs pour être écrits. Portez une attention particulière aux instructions fournies pour arrondir vos réponses.[36]
2 Soyez à l'aise d'arrondir de très grands nombres. Bien que l'arrondissement des nombres ne soit pas propre à la chimie, les réponses à certaines équations mathématiques complexes entraînent des nombres trop longs pour être écrits. Portez une attention particulière aux instructions fournies pour arrondir vos réponses.[36] - Savoir où arrondir ou baisser. Si le chiffre suivant dans la série est un 4 ou moins, arrondissez à la valeur inférieure, et s'il s'agit d'un arrondi supérieur ou égal à 5. Par exemple, considérons le numéro 6.66666666666666. Vous êtes invité à arrondir votre réponse à la deuxième décimale. La réponse est 6.67.[37]
-
 3 Comprendre la valeur absolue. En chimie, certains nombres sont appelés valeur absolue et non leur valeur mathématique réelle. La valeur absolue est la distance entre le nombre et zéro.
3 Comprendre la valeur absolue. En chimie, certains nombres sont appelés valeur absolue et non leur valeur mathématique réelle. La valeur absolue est la distance entre le nombre et zéro. - En d'autres termes, vous ne considérez plus positif ou négatif, juste la distance à zéro. Par exemple, la valeur absolue de -20 est 20.[38]
-
 4 Familiarisez-vous avec les unités de mesure acceptées. Voici quelques exemples.
4 Familiarisez-vous avec les unités de mesure acceptées. Voici quelques exemples. - Les mesures de la matière sont exprimées en moles (mol).
- La température est exprimée en degrés Fahrenheit (° F), Kelvin (° K) ou Celsius (° C).
- La masse est exprimée en grammes (g), en kilogrammes (kg) ou en milligrammes (mg).
- Les mesures liquides sont exprimées en litres (L) ou millilitres (ml).
-
 5 Pratiquer la conversion d'une échelle de mesure à une autre. Une partie du passage de votre cours de chimie consistera à effectuer des conversions d'une échelle acceptée à une autre. Cela peut inclure le passage d'une mesure de température à une autre, le changement de livres en kilogrammes et les onces en litres.
5 Pratiquer la conversion d'une échelle de mesure à une autre. Une partie du passage de votre cours de chimie consistera à effectuer des conversions d'une échelle acceptée à une autre. Cela peut inclure le passage d'une mesure de température à une autre, le changement de livres en kilogrammes et les onces en litres. - On pourrait vous demander de fournir des réponses dans des unités autres que celles figurant dans la question initiale. Par exemple, vous pouvez obtenir une équation de température à résoudre en degrés Celsius et vous demander de donner la réponse finale en Kelvin.
- Kelvin est la norme internationale pour les mesures de température souvent utilisées dans les réactions chimiques. Pratiquez le changement de degrés Celsius en degrés Kelvin ou Fahrenheit.
-
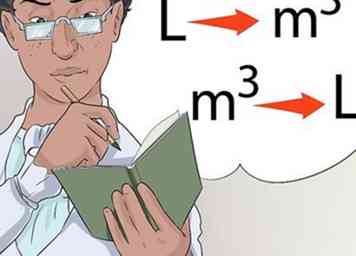 6 Prenez le temps de pratiquer. Lorsque vous êtes exposé à diverses conversions dans votre classe, prenez le temps d’apprendre à convertir l’un vers l’autre, et inversement.
6 Prenez le temps de pratiquer. Lorsque vous êtes exposé à diverses conversions dans votre classe, prenez le temps d’apprendre à convertir l’un vers l’autre, et inversement. -
 7 Savoir calculer les concentrations. Affûtez vos compétences de base en mathématiques dans les domaines des pourcentages, des ratios et des proportions.
7 Savoir calculer les concentrations. Affûtez vos compétences de base en mathématiques dans les domaines des pourcentages, des ratios et des proportions. -
 8 Pratique avec des étiquettes nutritionnelles sur les produits alimentaires. Pour passer la chimie, vous devrez être à l'aise de calculer les ratios, les proportions, les pourcentages, puis de nouveau. Si cela vous est difficile, pratiquez en utilisant d'autres unités de mesure courantes, comme celles que l'on trouve sur les étiquettes des aliments.
8 Pratique avec des étiquettes nutritionnelles sur les produits alimentaires. Pour passer la chimie, vous devrez être à l'aise de calculer les ratios, les proportions, les pourcentages, puis de nouveau. Si cela vous est difficile, pratiquez en utilisant d'autres unités de mesure courantes, comme celles que l'on trouve sur les étiquettes des aliments. - Regardez l'étiquette nutritionnelle sur tout produit alimentaire. Vous verrez des calories par portion, le pourcentage des AJR, les lipides totaux, les calories provenant des lipides, les glucides totaux et la répartition des différents types de glucides. Pratiquez en calculant différents ratios et proportions en utilisant différentes catégories pour le nombre inférieur.
- Par exemple, calculez la quantité de gras monoinsaturés par quantité totale de graisse. Changer cela à un pourcentage. Calculez le nombre de calories contenues dans le contenant en utilisant les chiffres fournis pour les calories par portion et les portions par contenant. Calculez la quantité de sodium contenue dans la moitié du contenant plein.
- En pratiquant des conversions comme celle-ci, quelles que soient les unités utilisées, vous serez beaucoup plus à l'aise pour échanger ces unités de mesure contre des mesures chimiques, telles que des moles par litre ou des grammes par ml, etc.
-
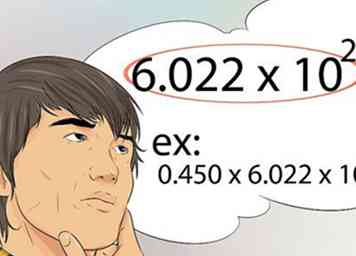 9 Savoir utiliser le numéro d'Avogadro. C'est le nombre qui représente le nombre de molécules, d'atomes ou de particules trouvés dans une mole. Le numéro d'Avogrado est 6.022x10 23.[39]
9 Savoir utiliser le numéro d'Avogadro. C'est le nombre qui représente le nombre de molécules, d'atomes ou de particules trouvés dans une mole. Le numéro d'Avogrado est 6.022x10 23.[39] - Par exemple, 0,450 mole de Fe contient combien d’atomes? La réponse est 0.450 x 6.022x10 23.[40]
-
 10 Pensez aux carottes. Si vous avez du mal à comprendre comment appliquer le numéro d'Avogadro, pensez en termes de carottes au lieu d'atomes, de molécules ou de particules. Combien de carottes en une douzaine? Eh bien, vous savez qu'une douzaine contient 12 de quelque chose, donc il y a 12 carottes dans une douzaine.
10 Pensez aux carottes. Si vous avez du mal à comprendre comment appliquer le numéro d'Avogadro, pensez en termes de carottes au lieu d'atomes, de molécules ou de particules. Combien de carottes en une douzaine? Eh bien, vous savez qu'une douzaine contient 12 de quelque chose, donc il y a 12 carottes dans une douzaine. - Maintenant, répondez à la question, combien de carottes sont dans un grain de beauté? Au lieu de multiplier par 12, vous multipliez en utilisant le numéro d'Avogadro. Donc, il y a 6.022 x 1023 carottes dans un mole.
- Le nombre d'Avogadro est utilisé pour convertir tout élément de substance, un atome, une molécule, une particule ou une carotte, en autant de quantité de cette chose contenue dans une mole.
- Si vous connaissez le nombre de moles de quelque chose, alors la valeur finale du nombre de molécules, d'atomes ou de particules présents est ce nombre multiplié par le nombre d'Avogrado.[41]
- Comprendre comment convertir les particules en moles est une partie importante de la chimie de passage. Les conversions molaires font partie du calcul des ratios et des proportions. Cela signifie la quantité de quelque chose dans les taupes dans le cadre de quelque chose d'autre.
-
 11 Se concentrer sur la compréhension de la molarité. Considérons le nombre de moles de quelque chose contenu dans un environnement liquide. Cet exemple est important à comprendre, puisque nous parlons maintenant de molarité, ou de la proportion de quelque chose exprimée en moles par litre.
11 Se concentrer sur la compréhension de la molarité. Considérons le nombre de moles de quelque chose contenu dans un environnement liquide. Cet exemple est important à comprendre, puisque nous parlons maintenant de molarité, ou de la proportion de quelque chose exprimée en moles par litre. - La molarité est couramment utilisée en chimie pour exprimer la quantité de quelque chose dans un environnement liquide ou la quantité de soluté contenue dans une solution liquide. La molarité est calculée en divisant les moles de soluté par les litres de solution. La molarité est exprimée en moles par litre.[42]
- Calculer la densité La densité est également une mesure couramment utilisée en chimie. La densité est la mesure de la masse par unité de volume d'une substance chimique. L'expression la plus courante pour la densité est donnée en grammes par millilitre ou en grammes par centimètre cube, ce qui est la même chose.[43]
-
 12 Convertir les équations à leur formule empirique. Cela signifie que les réponses finales aux équations seront considérées comme fausses à moins que vous ne les ayez divisées en leur forme la plus simple.[44]
12 Convertir les équations à leur formule empirique. Cela signifie que les réponses finales aux équations seront considérées comme fausses à moins que vous ne les ayez divisées en leur forme la plus simple.[44] - Cela ne s'applique pas aux formules moléculaires, car ce type de description vous indique les proportions exactes des éléments chimiques qui composent la molécule.[45]
-
 13 Savoir ce qui est inclus dans une formule moléculaire. Vous ne changez pas une formule moléculaire à sa forme la plus simple, ou empirique, car la formule moléculaire vous indique exactement ce qui constitue la molécule.
13 Savoir ce qui est inclus dans une formule moléculaire. Vous ne changez pas une formule moléculaire à sa forme la plus simple, ou empirique, car la formule moléculaire vous indique exactement ce qui constitue la molécule. - Une formule moléculaire est écrite dans un langage qui utilise l'abréviation du ou des éléments et combien d'atomes de chaque élément constituent la molécule.
- Par exemple, la formule moléculaire de l'eau est H2O. Cela signifie que chaque molécule d'eau contient 2 atomes d'hydrogène et 1 atome d'oxygène. La formule moléculaire de l'acétaminophène est C8H9NO2. Chaque composé chimique est représenté par sa formule moléculaire.
-
 14 Considérer les mathématiques de chimie comme stœchiométrie. Vous allez probablement rencontrer ce terme. C'est une description de la façon dont la chimie est exprimée à l'aide de formules mathématiques. En utilisant la chimie mathématique, ou la stoechiométrie, les valeurs des éléments et des composés chimiques sont souvent représentées en termes de moles, pourcentages molaires, moles par litre ou moles par kg.[46]
14 Considérer les mathématiques de chimie comme stœchiométrie. Vous allez probablement rencontrer ce terme. C'est une description de la façon dont la chimie est exprimée à l'aide de formules mathématiques. En utilisant la chimie mathématique, ou la stoechiométrie, les valeurs des éléments et des composés chimiques sont souvent représentées en termes de moles, pourcentages molaires, moles par litre ou moles par kg.[46] - En tant que procédure mathématique commune, vous devrez convertir des grammes en moles. L'unité de masse atomique d'un élément, en grammes, est égale à une mole de cette substance. Par exemple, le calcium a une masse de 40 unités de masse atomique. Par conséquent, 40 grammes de calcium équivalent à une mole de calcium.[47]
-
 15 Demandez des exemples supplémentaires. Si les équations mathématiques et les conversions ne vous sont pas faciles, parlez-en à votre professeur ou professeur. Demandez plus de problèmes que vous pouvez travailler vous-même, jusqu'à ce que les concepts impliqués et tous les facteurs de conversion aient un sens pour vous.
15 Demandez des exemples supplémentaires. Si les équations mathématiques et les conversions ne vous sont pas faciles, parlez-en à votre professeur ou professeur. Demandez plus de problèmes que vous pouvez travailler vous-même, jusqu'à ce que les concepts impliqués et tous les facteurs de conversion aient un sens pour vous.
Septième partie de huit:
Développer de bonnes habitudes d'étude
-
 1 Formez ou rejoignez un groupe d'étude. Ne soyez pas gêné si la chimie est difficile pour vous. C'est un sujet difficile pour presque tout le monde.
1 Formez ou rejoignez un groupe d'étude. Ne soyez pas gêné si la chimie est difficile pour vous. C'est un sujet difficile pour presque tout le monde. - En travaillant en groupe, certains membres trouveront des domaines plus faciles que d’autres et pourront partager leurs méthodes d’apprentissage avec le groupe. Diviser et conquérir.
-
 2 Lisez tous les chapitres de votre manuel de chimie. Lire un livre de chimie n'est pas toujours le livre le plus intéressant sur les tablettes. Mais prenez le temps de lire les sections assignées et mettez en évidence les parties qui ne semblent pas avoir de sens. Essayez de faire une liste de questions ou de concepts que vous avez du mal à comprendre.
2 Lisez tous les chapitres de votre manuel de chimie. Lire un livre de chimie n'est pas toujours le livre le plus intéressant sur les tablettes. Mais prenez le temps de lire les sections assignées et mettez en évidence les parties qui ne semblent pas avoir de sens. Essayez de faire une liste de questions ou de concepts que vous avez du mal à comprendre. - Revenez à ces parties plus tard et relevez-vous. S'ils vous semblent encore confus, parlez avec votre groupe d'étude, votre professeur ou un assistant pédagogique.
- Essayez de répondre aux questions à la fin du chapitre. La plupart des manuels fournissent des informations supplémentaires qui expliquent les réponses correctes au cas où quelque chose vous dérangerait.
- Les manuels scolaires utilisent des aides visuelles pour obtenir les principaux points d'enseignement. Regardez les visuels et faites attention aux légendes. Cela peut aider à éliminer une partie de la confusion.
-
 3 Demandez la permission d'enregistrer les conférences. Prendre des notes et regarder tout ce que le professeur écrit sur des tableaux ou des transparents est difficile à faire, en particulier dans un domaine difficile comme la chimie. Avoir un enregistrement que vous pouvez écouter encore et encore peut vous aider à comprendre. Cependant, vous devez toujours demander la permission d’enregistrer les cours avant de le faire.
3 Demandez la permission d'enregistrer les conférences. Prendre des notes et regarder tout ce que le professeur écrit sur des tableaux ou des transparents est difficile à faire, en particulier dans un domaine difficile comme la chimie. Avoir un enregistrement que vous pouvez écouter encore et encore peut vous aider à comprendre. Cependant, vous devez toujours demander la permission d’enregistrer les cours avant de le faire. - Essayez de dire quelque chose comme: «Je trouve plus facile d’étudier si je peux réécouter le cours pendant que je revois mes notes. Est-ce que ça irait si j'enregistrais tes cours pour que je puisse faire ça?
-
 4 Accédez à d'anciens tests ou à des guides d'étude. La plupart des cours de sciences naturelles, tels que la chimie, donnent accès à des questions de test antérieures pour aider les étudiants à se préparer à des tests majeurs.
4 Accédez à d'anciens tests ou à des guides d'étude. La plupart des cours de sciences naturelles, tels que la chimie, donnent accès à des questions de test antérieures pour aider les étudiants à se préparer à des tests majeurs. - Évitez simplement de mémoriser les réponses. La chimie est un sujet qu'il faut comprendre pour répondre à la même question si elle était formulée différemment.
Partie huit de huit:
Obtenir de l'aide
-
 1 Apprenez à connaître votre professeur ou enseignant. Pour réussir la chimie avec la meilleure note possible, prenez le temps de rencontrer la personne qui enseigne la classe. Si vous éprouvez des difficultés, dites-leur que c'est difficile pour vous. Cependant, même si vous vous en sortez bien, c'est une bonne idée de faire connaissance avec le professeur.
1 Apprenez à connaître votre professeur ou enseignant. Pour réussir la chimie avec la meilleure note possible, prenez le temps de rencontrer la personne qui enseigne la classe. Si vous éprouvez des difficultés, dites-leur que c'est difficile pour vous. Cependant, même si vous vous en sortez bien, c'est une bonne idée de faire connaissance avec le professeur. - De nombreux professeurs ont des guides d'étude disponibles et ouvrent des heures supplémentaires pour aider les étudiants en cas de besoin.
- Conservez une liste des domaines difficiles et demandez à votre professeur ou enseignant de vous aider. Cela vous donne l'occasion de comprendre les sujets difficiles avant que la classe ne passe à la section suivante, et vous devenez encore plus confus.
-
 2 Visitez les ressources d'aide en ligne. Faites attention aux ressources en ligne ou aux liens fournis par le département de chimie de votre propre école.
2 Visitez les ressources d'aide en ligne. Faites attention aux ressources en ligne ou aux liens fournis par le département de chimie de votre propre école. -
 3 Essayez de ne pas être dépassé. Les informations détaillées sur les différents types de réactions chimiques, le partage des électrons, la modification de la charge d'un élément ou d'un composé et la connaissance des différents types de réactions peuvent être très déroutants.
3 Essayez de ne pas être dépassé. Les informations détaillées sur les différents types de réactions chimiques, le partage des électrons, la modification de la charge d'un élément ou d'un composé et la connaissance des différents types de réactions peuvent être très déroutants. - Décomposez les zones difficiles en termes descriptibles. Par exemple, sachez que vous ne comprenez pas les réactions d'oxydation ou comment combiner des éléments avec des charges positives et négatives. En verbalisant les zones que vous avez de la difficulté à comprendre, vous pouvez également être rassuré en réalisant que vous avez beaucoup appris et que vous comprenez.
 Minotauromaquia
Minotauromaquia
 1 Commencez par les structures les plus élémentaires. Pour réussir votre cours de chimie, vous devrez bien comprendre les éléments constitutifs de tout ce qui a une substance ou une masse.
1 Commencez par les structures les plus élémentaires. Pour réussir votre cours de chimie, vous devrez bien comprendre les éléments constitutifs de tout ce qui a une substance ou une masse.  2 Saisir le concept d'un atome. Un atome est considéré comme le plus petit élément constitutif de tout ce qui a une masse, y compris des choses que nous ne pouvons pas toujours voir, comme les gaz. Mais même le minuscule atome possède des parties encore plus petites qui constituent sa structure.[1]
2 Saisir le concept d'un atome. Un atome est considéré comme le plus petit élément constitutif de tout ce qui a une masse, y compris des choses que nous ne pouvons pas toujours voir, comme les gaz. Mais même le minuscule atome possède des parties encore plus petites qui constituent sa structure.[1]  3 Comprendre le cadre atomique d'un élément. Un élément est considéré comme une substance dans la nature qui ne peut être décomposée en aucun autre élément ou sous une forme plus simple. Les éléments sont constitués d'atomes.[4]
3 Comprendre le cadre atomique d'un élément. Un élément est considéré comme une substance dans la nature qui ne peut être décomposée en aucun autre élément ou sous une forme plus simple. Les éléments sont constitués d'atomes.[4]  4 Comprendre plus sur le noyau. Les neutrons, trouvés dans le noyau, ont une charge neutre. Les protons ont une charge positive. Le numéro atomique d'un élément est exactement le même que le nombre de protons contenus dans le noyau.[6]
4 Comprendre plus sur le noyau. Les neutrons, trouvés dans le noyau, ont une charge neutre. Les protons ont une charge positive. Le numéro atomique d'un élément est exactement le même que le nombre de protons contenus dans le noyau.[6]  5 Reconnaître les diagrammes de Lewis. Les diagrammes de Lewis sont parfois appelés diagrammes électron-point. Ce sont des diagrammes simples qui utilisent des points pour représenter les électrons appariés et non appariés dans la couche externe d'un atome.[7]
5 Reconnaître les diagrammes de Lewis. Les diagrammes de Lewis sont parfois appelés diagrammes électron-point. Ce sont des diagrammes simples qui utilisent des points pour représenter les électrons appariés et non appariés dans la couche externe d'un atome.[7]  6 Savoir ce que signifie la règle d'octet. Les diagrammes de Lewis opèrent sur la règle des octets, qui stipule que les atomes sont stables quand ils ont accès à huit électrons dans la coque externe. L'hydrogène est l'exception et est considéré comme stable avec deux électrons dans la coque externe.[9]
6 Savoir ce que signifie la règle d'octet. Les diagrammes de Lewis opèrent sur la règle des octets, qui stipule que les atomes sont stables quand ils ont accès à huit électrons dans la coque externe. L'hydrogène est l'exception et est considéré comme stable avec deux électrons dans la coque externe.[9]  7 Dessine un diagramme de Lewis. Le symbole d'un élément, entouré d'un arrangement de points, est un diagramme de Lewis. Considérez le diagramme comme une image fixe d’un film. Au lieu que les électrons tournoient autour de l'extérieur de l'élément, ils sont représentés comme un moment fixe dans le temps.[10]
7 Dessine un diagramme de Lewis. Le symbole d'un élément, entouré d'un arrangement de points, est un diagramme de Lewis. Considérez le diagramme comme une image fixe d’un film. Au lieu que les électrons tournoient autour de l'extérieur de l'élément, ils sont représentés comme un moment fixe dans le temps.[10]  8 Comprendre l'arrangement des électrons comme ils lient des éléments ensemble. Les diagrammes de Lewis sont une représentation visuelle simpliste de ce que l'on comprend des liaisons chimiques.
8 Comprendre l'arrangement des électrons comme ils lient des éléments ensemble. Les diagrammes de Lewis sont une représentation visuelle simpliste de ce que l'on comprend des liaisons chimiques.  1 Regardez le tableau périodique. Si vous rencontrez des problèmes avec les propriétés des éléments, passez du temps à examiner tout élément disponible dans le tableau périodique. Plus important encore, regardez-en un.
1 Regardez le tableau périodique. Si vous rencontrez des problèmes avec les propriétés des éléments, passez du temps à examiner tout élément disponible dans le tableau périodique. Plus important encore, regardez-en un.  4 Trouvez la masse atomique de chaque élément. Le nombre en bas est la masse atomique. Rappelez-vous que le nombre de protons combiné au nombre de neutrons trouvés dans le noyau est égal au nombre de masse atomique.[14]
4 Trouvez la masse atomique de chaque élément. Le nombre en bas est la masse atomique. Rappelez-vous que le nombre de protons combiné au nombre de neutrons trouvés dans le noyau est égal au nombre de masse atomique.[14]  5 Calculez le nombre de neutrons trouvés dans le noyau. Vous pouvez utiliser les chiffres fournis dans le tableau périodique pour le déterminer. Le numéro atomique de tout élément est exactement le même que le nombre de protons trouvés dans le noyau.
5 Calculez le nombre de neutrons trouvés dans le noyau. Vous pouvez utiliser les chiffres fournis dans le tableau périodique pour le déterminer. Le numéro atomique de tout élément est exactement le même que le nombre de protons trouvés dans le noyau.  6 Calculez le nombre d'électrons. Rappelez-vous que les contraires attirent. Les électrons sont des particules chargées positivement qui volent autour du noyau d'un atome, comme les planètes qui tournent autour du soleil. Le nombre d'électrons chargés négativement qui sont attirés vers le noyau dépend du nombre de protons chargés positivement situés dans le noyau.
6 Calculez le nombre d'électrons. Rappelez-vous que les contraires attirent. Les électrons sont des particules chargées positivement qui volent autour du noyau d'un atome, comme les planètes qui tournent autour du soleil. Le nombre d'électrons chargés négativement qui sont attirés vers le noyau dépend du nombre de protons chargés positivement situés dans le noyau.  1 Équilibrer une équation chimique. Dans un cours de chimie, vous devrez savoir comment prédire ce qui se passera lorsque des éléments sont combinés. Sur le papier, cela s'appelle les équations chimiques d'équilibrage.[17]
1 Équilibrer une équation chimique. Dans un cours de chimie, vous devrez savoir comment prédire ce qui se passera lorsque des éléments sont combinés. Sur le papier, cela s'appelle les équations chimiques d'équilibrage.[17]  2 Pensez aux équations différemment. Si vous ne parvenez pas à trouver un équilibre entre les équations chimiques, pensez à l’équation dans le cadre d’une recette, mais celle-ci doit être ajustée des deux côtés afin de réduire votre consommation au minimum.
2 Pensez aux équations différemment. Si vous ne parvenez pas à trouver un équilibre entre les équations chimiques, pensez à l’équation dans le cadre d’une recette, mais celle-ci doit être ajustée des deux côtés afin de réduire votre consommation au minimum. 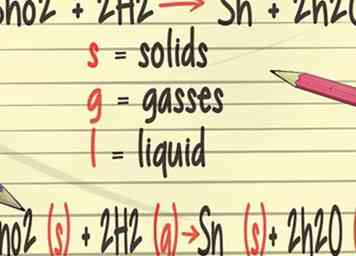 3 Ajoutez plus de détails à vos équations équilibrées. Dans votre cours de chimie, vous apprendrez à ajouter des symboles à vos équations équilibrées qui représentent l'état physique des éléments. Ces symboles incluront (s) pour les solides, (g) pour les gaz et (l) pour les liquides.[21]
3 Ajoutez plus de détails à vos équations équilibrées. Dans votre cours de chimie, vous apprendrez à ajouter des symboles à vos équations équilibrées qui représentent l'état physique des éléments. Ces symboles incluront (s) pour les solides, (g) pour les gaz et (l) pour les liquides.[21]  4 Identifier les changements qui surviennent dans une réaction chimique. Les réactions chimiques commencent par les éléments de base, ou des éléments déjà combinés, appelés réactifs. La combinaison de deux réactifs ou plus donne un seul produit ou plusieurs produits.
4 Identifier les changements qui surviennent dans une réaction chimique. Les réactions chimiques commencent par les éléments de base, ou des éléments déjà combinés, appelés réactifs. La combinaison de deux réactifs ou plus donne un seul produit ou plusieurs produits.  1 Reconnaître les types de réactions. De nombreuses influences peuvent entraîner des réactions chimiques, en plus de la simple combinaison d'ingrédients.
1 Reconnaître les types de réactions. De nombreuses influences peuvent entraîner des réactions chimiques, en plus de la simple combinaison d'ingrédients.  2 Utilisez les ressources fournies. Vous devrez saisir les différences dans chaque type de réaction traité dans votre classe. Utilisez les ressources mises à votre disposition par votre enseignant ou professeur pour comprendre les différents types de réactions abordées dans votre classe. N'ayez pas peur de poser des questions.
2 Utilisez les ressources fournies. Vous devrez saisir les différences dans chaque type de réaction traité dans votre classe. Utilisez les ressources mises à votre disposition par votre enseignant ou professeur pour comprendre les différents types de réactions abordées dans votre classe. N'ayez pas peur de poser des questions.  3 Réfléchissez logiquement aux réactions chimiques. Essayez de ne pas le rendre plus difficile qu’il ne l’est déjà en vous mettant dans la terminologie.Les types de réactions chimiques que vous allez apprendre impliquent simplement de faire quelque chose pour changer quelque chose.
3 Réfléchissez logiquement aux réactions chimiques. Essayez de ne pas le rendre plus difficile qu’il ne l’est déjà en vous mettant dans la terminologie.Les types de réactions chimiques que vous allez apprendre impliquent simplement de faire quelque chose pour changer quelque chose.  1 Apprenez comment les composés sont nommés. La chimie a ses propres règles de nomenclature. Les types de réactions qui se produisent avec les composés chimiques, la perte ou le gain d'électrons dans leur enveloppe externe et la stabilité ou l'instabilité des composés font partie de la nomenclature chimique.
1 Apprenez comment les composés sont nommés. La chimie a ses propres règles de nomenclature. Les types de réactions qui se produisent avec les composés chimiques, la perte ou le gain d'électrons dans leur enveloppe externe et la stabilité ou l'instabilité des composés font partie de la nomenclature chimique.  2 Prenez au sérieux la section sur la nomenclature. La plupart des cours de chimie débutants ont une section consacrée uniquement à la nomenclature. Dans certaines écoles, le fait de ne pas réussir la partie nomenclature de la classe signifie échouer à la classe.
2 Prenez au sérieux la section sur la nomenclature. La plupart des cours de chimie débutants ont une section consacrée uniquement à la nomenclature. Dans certaines écoles, le fait de ne pas réussir la partie nomenclature de la classe signifie échouer à la classe. 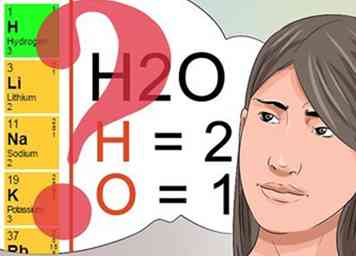 3 Savoir ce que les numéros en exposant et en indice indiquent. Comprendre ce que signifient les chiffres en exposant et en indice sera essentiel pour réussir votre cours de chimie.[24]
3 Savoir ce que les numéros en exposant et en indice indiquent. Comprendre ce que signifient les chiffres en exposant et en indice sera essentiel pour réussir votre cours de chimie.[24]  4 Reconnaître comment les atomes réagissent les uns avec les autres. Une partie de la nomenclature utilisée en chimie implique des règles spécifiques pour nommer les produits à partir de types spécifiques de réactions.[25]
4 Reconnaître comment les atomes réagissent les uns avec les autres. Une partie de la nomenclature utilisée en chimie implique des règles spécifiques pour nommer les produits à partir de types spécifiques de réactions.[25]  5 Reconnaître que les indices peuvent indiquer la formule pour une charge stable à un composé. Les scientifiques utilisent des indices pour identifier la formule moléculaire finale d'un composé, qui indique également un composé stable avec une charge neutre.
5 Reconnaître que les indices peuvent indiquer la formule pour une charge stable à un composé. Les scientifiques utilisent des indices pour identifier la formule moléculaire finale d'un composé, qui indique également un composé stable avec une charge neutre.  6 Identifier les anions et les cations de leur position sur le tableau périodique. Les éléments du tableau périodique qui se trouvent dans la première colonne d'éléments sont considérés comme des alcalis, et forment des charges de 1 cation. Par exemple Na + et Li +.[30]
6 Identifier les anions et les cations de leur position sur le tableau périodique. Les éléments du tableau périodique qui se trouvent dans la première colonne d'éléments sont considérés comme des alcalis, et forment des charges de 1 cation. Par exemple Na + et Li +.[30]  7 Apprenez à reconnaître les anions et les cations les plus communs. Pour vous aider à réussir votre cours de chimie, soyez aussi familier que possible avec la nomenclature associée aux groupes d’éléments. Ce type d'exposant ne change pas.[33]
7 Apprenez à reconnaître les anions et les cations les plus communs. Pour vous aider à réussir votre cours de chimie, soyez aussi familier que possible avec la nomenclature associée aux groupes d’éléments. Ce type d'exposant ne change pas.[33]  8 Pensez à la chimie en apprenant une nouvelle langue. Comprenez que les formes écrites d'indication de charges, le nombre d'atomes dans une molécule et les liaisons formées pour maintenir les molécules ensemble font toutes partie du langage de la chimie. Tout cela est une manière écrite de représenter ce qui se passe dans les réactions chimiques qui ne peuvent pas réellement être vues.
8 Pensez à la chimie en apprenant une nouvelle langue. Comprenez que les formes écrites d'indication de charges, le nombre d'atomes dans une molécule et les liaisons formées pour maintenir les molécules ensemble font toutes partie du langage de la chimie. Tout cela est une manière écrite de représenter ce qui se passe dans les réactions chimiques qui ne peuvent pas réellement être vues.  1 Connaître la séquence pour les calculs mathématiques de base. En chimie, des calculs très détaillés sont parfois nécessaires, mais d'autres fois, seules les compétences de base en mathématiques sont suffisantes. Il est important de comprendre la séquence appropriée pour effectuer les calculs dans une équation.[35]
1 Connaître la séquence pour les calculs mathématiques de base. En chimie, des calculs très détaillés sont parfois nécessaires, mais d'autres fois, seules les compétences de base en mathématiques sont suffisantes. Il est important de comprendre la séquence appropriée pour effectuer les calculs dans une équation.[35]  2 Soyez à l'aise d'arrondir de très grands nombres. Bien que l'arrondissement des nombres ne soit pas propre à la chimie, les réponses à certaines équations mathématiques complexes entraînent des nombres trop longs pour être écrits. Portez une attention particulière aux instructions fournies pour arrondir vos réponses.[36]
2 Soyez à l'aise d'arrondir de très grands nombres. Bien que l'arrondissement des nombres ne soit pas propre à la chimie, les réponses à certaines équations mathématiques complexes entraînent des nombres trop longs pour être écrits. Portez une attention particulière aux instructions fournies pour arrondir vos réponses.[36]  3 Comprendre la valeur absolue. En chimie, certains nombres sont appelés valeur absolue et non leur valeur mathématique réelle. La valeur absolue est la distance entre le nombre et zéro.
3 Comprendre la valeur absolue. En chimie, certains nombres sont appelés valeur absolue et non leur valeur mathématique réelle. La valeur absolue est la distance entre le nombre et zéro.  4 Familiarisez-vous avec les unités de mesure acceptées. Voici quelques exemples.
4 Familiarisez-vous avec les unités de mesure acceptées. Voici quelques exemples.  5 Pratiquer la conversion d'une échelle de mesure à une autre. Une partie du passage de votre cours de chimie consistera à effectuer des conversions d'une échelle acceptée à une autre. Cela peut inclure le passage d'une mesure de température à une autre, le changement de livres en kilogrammes et les onces en litres.
5 Pratiquer la conversion d'une échelle de mesure à une autre. Une partie du passage de votre cours de chimie consistera à effectuer des conversions d'une échelle acceptée à une autre. Cela peut inclure le passage d'une mesure de température à une autre, le changement de livres en kilogrammes et les onces en litres.  6 Prenez le temps de pratiquer. Lorsque vous êtes exposé à diverses conversions dans votre classe, prenez le temps d’apprendre à convertir l’un vers l’autre, et inversement.
6 Prenez le temps de pratiquer. Lorsque vous êtes exposé à diverses conversions dans votre classe, prenez le temps d’apprendre à convertir l’un vers l’autre, et inversement.  7 Savoir calculer les concentrations. Affûtez vos compétences de base en mathématiques dans les domaines des pourcentages, des ratios et des proportions.
7 Savoir calculer les concentrations. Affûtez vos compétences de base en mathématiques dans les domaines des pourcentages, des ratios et des proportions.  8 Pratique avec des étiquettes nutritionnelles sur les produits alimentaires. Pour passer la chimie, vous devrez être à l'aise de calculer les ratios, les proportions, les pourcentages, puis de nouveau. Si cela vous est difficile, pratiquez en utilisant d'autres unités de mesure courantes, comme celles que l'on trouve sur les étiquettes des aliments.
8 Pratique avec des étiquettes nutritionnelles sur les produits alimentaires. Pour passer la chimie, vous devrez être à l'aise de calculer les ratios, les proportions, les pourcentages, puis de nouveau. Si cela vous est difficile, pratiquez en utilisant d'autres unités de mesure courantes, comme celles que l'on trouve sur les étiquettes des aliments. 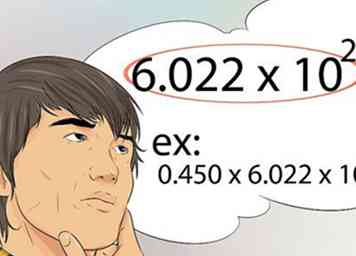 9 Savoir utiliser le numéro d'Avogadro. C'est le nombre qui représente le nombre de molécules, d'atomes ou de particules trouvés dans une mole. Le numéro d'Avogrado est 6.022x10 23.[39]
9 Savoir utiliser le numéro d'Avogadro. C'est le nombre qui représente le nombre de molécules, d'atomes ou de particules trouvés dans une mole. Le numéro d'Avogrado est 6.022x10 23.[39]  10 Pensez aux carottes. Si vous avez du mal à comprendre comment appliquer le numéro d'Avogadro, pensez en termes de carottes au lieu d'atomes, de molécules ou de particules. Combien de carottes en une douzaine? Eh bien, vous savez qu'une douzaine contient 12 de quelque chose, donc il y a 12 carottes dans une douzaine.
10 Pensez aux carottes. Si vous avez du mal à comprendre comment appliquer le numéro d'Avogadro, pensez en termes de carottes au lieu d'atomes, de molécules ou de particules. Combien de carottes en une douzaine? Eh bien, vous savez qu'une douzaine contient 12 de quelque chose, donc il y a 12 carottes dans une douzaine.  11 Se concentrer sur la compréhension de la molarité. Considérons le nombre de moles de quelque chose contenu dans un environnement liquide. Cet exemple est important à comprendre, puisque nous parlons maintenant de molarité, ou de la proportion de quelque chose exprimée en moles par litre.
11 Se concentrer sur la compréhension de la molarité. Considérons le nombre de moles de quelque chose contenu dans un environnement liquide. Cet exemple est important à comprendre, puisque nous parlons maintenant de molarité, ou de la proportion de quelque chose exprimée en moles par litre.  12 Convertir les équations à leur formule empirique. Cela signifie que les réponses finales aux équations seront considérées comme fausses à moins que vous ne les ayez divisées en leur forme la plus simple.[44]
12 Convertir les équations à leur formule empirique. Cela signifie que les réponses finales aux équations seront considérées comme fausses à moins que vous ne les ayez divisées en leur forme la plus simple.[44]  13 Savoir ce qui est inclus dans une formule moléculaire. Vous ne changez pas une formule moléculaire à sa forme la plus simple, ou empirique, car la formule moléculaire vous indique exactement ce qui constitue la molécule.
13 Savoir ce qui est inclus dans une formule moléculaire. Vous ne changez pas une formule moléculaire à sa forme la plus simple, ou empirique, car la formule moléculaire vous indique exactement ce qui constitue la molécule.  14 Considérer les mathématiques de chimie comme stœchiométrie. Vous allez probablement rencontrer ce terme. C'est une description de la façon dont la chimie est exprimée à l'aide de formules mathématiques. En utilisant la chimie mathématique, ou la stoechiométrie, les valeurs des éléments et des composés chimiques sont souvent représentées en termes de moles, pourcentages molaires, moles par litre ou moles par kg.[46]
14 Considérer les mathématiques de chimie comme stœchiométrie. Vous allez probablement rencontrer ce terme. C'est une description de la façon dont la chimie est exprimée à l'aide de formules mathématiques. En utilisant la chimie mathématique, ou la stoechiométrie, les valeurs des éléments et des composés chimiques sont souvent représentées en termes de moles, pourcentages molaires, moles par litre ou moles par kg.[46]  15 Demandez des exemples supplémentaires. Si les équations mathématiques et les conversions ne vous sont pas faciles, parlez-en à votre professeur ou professeur. Demandez plus de problèmes que vous pouvez travailler vous-même, jusqu'à ce que les concepts impliqués et tous les facteurs de conversion aient un sens pour vous.
15 Demandez des exemples supplémentaires. Si les équations mathématiques et les conversions ne vous sont pas faciles, parlez-en à votre professeur ou professeur. Demandez plus de problèmes que vous pouvez travailler vous-même, jusqu'à ce que les concepts impliqués et tous les facteurs de conversion aient un sens pour vous.  1 Formez ou rejoignez un groupe d'étude. Ne soyez pas gêné si la chimie est difficile pour vous. C'est un sujet difficile pour presque tout le monde.
1 Formez ou rejoignez un groupe d'étude. Ne soyez pas gêné si la chimie est difficile pour vous. C'est un sujet difficile pour presque tout le monde.  2 Lisez tous les chapitres de votre manuel de chimie. Lire un livre de chimie n'est pas toujours le livre le plus intéressant sur les tablettes. Mais prenez le temps de lire les sections assignées et mettez en évidence les parties qui ne semblent pas avoir de sens. Essayez de faire une liste de questions ou de concepts que vous avez du mal à comprendre.
2 Lisez tous les chapitres de votre manuel de chimie. Lire un livre de chimie n'est pas toujours le livre le plus intéressant sur les tablettes. Mais prenez le temps de lire les sections assignées et mettez en évidence les parties qui ne semblent pas avoir de sens. Essayez de faire une liste de questions ou de concepts que vous avez du mal à comprendre.  3 Demandez la permission d'enregistrer les conférences. Prendre des notes et regarder tout ce que le professeur écrit sur des tableaux ou des transparents est difficile à faire, en particulier dans un domaine difficile comme la chimie. Avoir un enregistrement que vous pouvez écouter encore et encore peut vous aider à comprendre. Cependant, vous devez toujours demander la permission d’enregistrer les cours avant de le faire.
3 Demandez la permission d'enregistrer les conférences. Prendre des notes et regarder tout ce que le professeur écrit sur des tableaux ou des transparents est difficile à faire, en particulier dans un domaine difficile comme la chimie. Avoir un enregistrement que vous pouvez écouter encore et encore peut vous aider à comprendre. Cependant, vous devez toujours demander la permission d’enregistrer les cours avant de le faire.  4 Accédez à d'anciens tests ou à des guides d'étude. La plupart des cours de sciences naturelles, tels que la chimie, donnent accès à des questions de test antérieures pour aider les étudiants à se préparer à des tests majeurs.
4 Accédez à d'anciens tests ou à des guides d'étude. La plupart des cours de sciences naturelles, tels que la chimie, donnent accès à des questions de test antérieures pour aider les étudiants à se préparer à des tests majeurs.  1 Apprenez à connaître votre professeur ou enseignant. Pour réussir la chimie avec la meilleure note possible, prenez le temps de rencontrer la personne qui enseigne la classe. Si vous éprouvez des difficultés, dites-leur que c'est difficile pour vous. Cependant, même si vous vous en sortez bien, c'est une bonne idée de faire connaissance avec le professeur.
1 Apprenez à connaître votre professeur ou enseignant. Pour réussir la chimie avec la meilleure note possible, prenez le temps de rencontrer la personne qui enseigne la classe. Si vous éprouvez des difficultés, dites-leur que c'est difficile pour vous. Cependant, même si vous vous en sortez bien, c'est une bonne idée de faire connaissance avec le professeur.  2 Visitez les ressources d'aide en ligne. Faites attention aux ressources en ligne ou aux liens fournis par le département de chimie de votre propre école.
2 Visitez les ressources d'aide en ligne. Faites attention aux ressources en ligne ou aux liens fournis par le département de chimie de votre propre école.  3 Essayez de ne pas être dépassé. Les informations détaillées sur les différents types de réactions chimiques, le partage des électrons, la modification de la charge d'un élément ou d'un composé et la connaissance des différents types de réactions peuvent être très déroutants.
3 Essayez de ne pas être dépassé. Les informations détaillées sur les différents types de réactions chimiques, le partage des électrons, la modification de la charge d'un élément ou d'un composé et la connaissance des différents types de réactions peuvent être très déroutants.