Si vous trouvez le tableau périodique confus et difficile à comprendre, vous n'êtes pas seul! Comprendre son fonctionnement peut être difficile, mais apprendre à le lire vous aidera à réussir en sciences. Commencez par reconnaître la structure du tableau périodique et ce que cela vous dit sur chaque élément. Ensuite, vous pouvez étudier chaque élément. Enfin, utilisez les informations fournies dans le tableau périodique pour trouver le nombre de neutrons dans un atome.
Première partie de trois:
Reconnaître la structure du tableau périodique
-
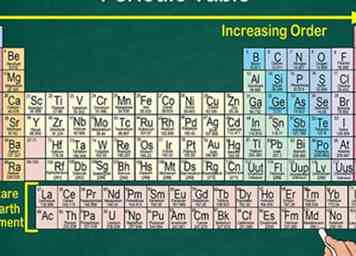 1 Lisez le tableau périodique de gauche à droite en haut à droite. Les éléments sont classés en fonction de leurs numéros atomiques, qui augmentent à mesure que vous vous déplacez dans le tableau périodique. Le nombre atomique est le nombre de protons que possède l'atome de l'élément. Vous remarquerez également que la masse atomique de chaque élément augmente à mesure que vous vous déplacez sur la table. Cela signifie que vous pouvez reconnaître beaucoup sur le poids d'un élément en regardant simplement sa place sur la table.
1 Lisez le tableau périodique de gauche à droite en haut à droite. Les éléments sont classés en fonction de leurs numéros atomiques, qui augmentent à mesure que vous vous déplacez dans le tableau périodique. Le nombre atomique est le nombre de protons que possède l'atome de l'élément. Vous remarquerez également que la masse atomique de chaque élément augmente à mesure que vous vous déplacez sur la table. Cela signifie que vous pouvez reconnaître beaucoup sur le poids d'un élément en regardant simplement sa place sur la table. - La masse atomique augmente au fur et à mesure que vous vous déplacez de haut en bas, car la masse est calculée en additionnant les protons et les neutrons dans l'atome de chaque élément. Le nombre de protons augmente avec chaque élément, ce qui signifie que le poids augmente également.
- Les électrons ne sont pas inclus dans la masse atomique, car ils contribuent beaucoup moins au poids de l'atome que les protons et les neutrons.[1]
-
 2 Notez que chaque élément contient 1 proton de plus que son prédécesseur. Vous pouvez le dire en regardant le numéro atomique. Les numéros atomiques sont classés de gauche à droite. Comme les éléments sont également classés par groupe, vous verrez des lacunes sur la table.[2]
2 Notez que chaque élément contient 1 proton de plus que son prédécesseur. Vous pouvez le dire en regardant le numéro atomique. Les numéros atomiques sont classés de gauche à droite. Comme les éléments sont également classés par groupe, vous verrez des lacunes sur la table.[2] - Par exemple, la première ligne contient de l'hydrogène, qui a un numéro atomique de 1, et de l'hélium, qui a un numéro atomique de 2. Cependant, ils se trouvent aux extrémités opposées de la table, car ils sont dans des groupes différents.
-
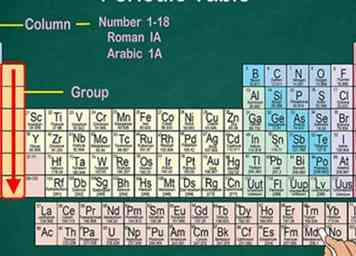 3 Reconnaître les groupes qui partagent des propriétés physiques et chimiques. Les groupes, également appelés familles, se trouvent dans une colonne verticale. Dans la plupart des cas, les groupes partagent également la même couleur. Cela vous aide à identifier les éléments ayant des propriétés physiques et chimiques similaires, ce qui vous permet de prévoir leur comportement.[3] Chaque élément d'un groupe particulier a le même nombre d'électrons dans son orbitale externe.[4]
3 Reconnaître les groupes qui partagent des propriétés physiques et chimiques. Les groupes, également appelés familles, se trouvent dans une colonne verticale. Dans la plupart des cas, les groupes partagent également la même couleur. Cela vous aide à identifier les éléments ayant des propriétés physiques et chimiques similaires, ce qui vous permet de prévoir leur comportement.[3] Chaque élément d'un groupe particulier a le même nombre d'électrons dans son orbitale externe.[4] - La plupart des éléments appartiennent à un groupe, mais l'hydrogène peut être associé à la famille des halogènes ou aux métaux alcalins. Sur certains graphiques, il apparaîtra avec les deux.
- Dans la plupart des cas, les colonnes seront numérotées de 1 à 18, au-dessus ou au-dessous du tableau. Les numéros peuvent être indiqués en chiffres romains (IA), en chiffres arabes (1A) ou en chiffres (1).
- Lorsque vous descendez d'un groupe de haut en bas, cela s'appelle «lire un groupe».
-
 4 Notez pourquoi des lacunes existent dans le tableau. Bien que les éléments soient classés en fonction de leur numéro atomique, ils sont également organisés en groupes et familles partageant les mêmes propriétés physiques et chimiques. Cela vous aide à mieux comprendre le comportement de chaque élément. Étant donné que les éléments ne sont pas toujours parfaitement groupés au fur et à mesure que leur nombre augmente, le tableau périodique contient des lacunes.[5]
4 Notez pourquoi des lacunes existent dans le tableau. Bien que les éléments soient classés en fonction de leur numéro atomique, ils sont également organisés en groupes et familles partageant les mêmes propriétés physiques et chimiques. Cela vous aide à mieux comprendre le comportement de chaque élément. Étant donné que les éléments ne sont pas toujours parfaitement groupés au fur et à mesure que leur nombre augmente, le tableau périodique contient des lacunes.[5] - Par exemple, les trois premières lignes comportent des espaces, car les métaux de transition n'apparaissent pas sur la table avant le numéro atomique 21.
- De même, les éléments 57 à 102, qui sont les éléments de terres rares, sont généralement représentés en tant que sous-ensemble en bas à droite du tableau.
-
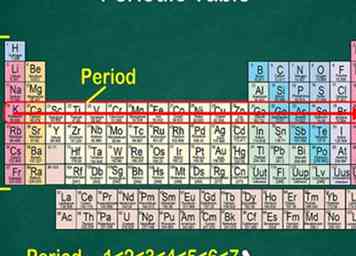 5 Notez que chaque ligne est appelée une période. Tous les éléments d'une période ont le même nombre d'orbitales atomiques, c'est là que vont leurs électrons. Le nombre d'orbitales correspondra au nombre de la période. Il y a 7 lignes, ce qui signifie qu'il y a 7 périodes.[6]
5 Notez que chaque ligne est appelée une période. Tous les éléments d'une période ont le même nombre d'orbitales atomiques, c'est là que vont leurs électrons. Le nombre d'orbitales correspondra au nombre de la période. Il y a 7 lignes, ce qui signifie qu'il y a 7 périodes.[6] - Par exemple, les éléments de la période 1 ont 1 orbitale, tandis que les éléments de la période 7 ont 7 orbitales.
- Dans la plupart des cas, ils sont numérotés de 1 à 7 sur le côté gauche du tableau.
- Lorsque vous passez d'une rangée de gauche à droite, cela s'appelle «lire sur une période».
-
 6 Distinguer les métaux, les semi-métaux et les non-métaux. Vous pouvez mieux comprendre les propriétés d'un élément en reconnaissant son type. Heureusement, la plupart des tableaux périodiques utilisent des couleurs pour indiquer si l'élément est un métal, un semi-métal ou un non-métal. Vous remarquerez que les métaux se trouvent à gauche de la table, tandis que les non-métaux tombent à droite. Les semi-métaux sont pris en sandwich entre eux.[7]
6 Distinguer les métaux, les semi-métaux et les non-métaux. Vous pouvez mieux comprendre les propriétés d'un élément en reconnaissant son type. Heureusement, la plupart des tableaux périodiques utilisent des couleurs pour indiquer si l'élément est un métal, un semi-métal ou un non-métal. Vous remarquerez que les métaux se trouvent à gauche de la table, tandis que les non-métaux tombent à droite. Les semi-métaux sont pris en sandwich entre eux.[7] - N'oubliez pas que l'hydrogène peut être regroupé avec les halogènes ou les métaux alcalins en raison de ses propriétés. Il peut donc apparaître de chaque côté du tableau ou être coloré différemment.
- Les éléments sont étiquetés comme un métal s'ils ont un éclat, sont solides à température ambiante, conduisent de la chaleur et de l'électricité et sont malléables et ductiles.
- Les éléments sont considérés comme non métalliques s'ils manquent d'éclat, ne conduisent pas la chaleur ou l'électricité et ne sont pas malléables. Ces éléments sont généralement des gaz à température ambiante mais peuvent également devenir solides ou liquides à certaines températures.
- Les éléments sont étiquetés comme des semi-métaux s'ils ont un mélange de propriétés des métaux et des non-métaux.[8]
Deuxième partie de trois:
Etudier les éléments
-
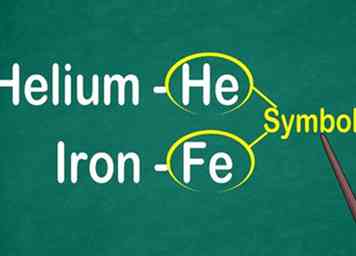 1 Reconnaître le symbole de 1 à 2 lettres de l'élément. Il apparaît le plus souvent au centre de la boîte dans une grande police. Le symbole abrégé le nom de l'élément, qui est normalisé dans différentes langues. Lorsque vous faites des expériences ou travaillez avec des équations élémentaires, vous utiliserez probablement les symboles des éléments, il est donc important de vous familiariser avec eux.[9]
1 Reconnaître le symbole de 1 à 2 lettres de l'élément. Il apparaît le plus souvent au centre de la boîte dans une grande police. Le symbole abrégé le nom de l'élément, qui est normalisé dans différentes langues. Lorsque vous faites des expériences ou travaillez avec des équations élémentaires, vous utiliserez probablement les symboles des éléments, il est donc important de vous familiariser avec eux.[9] - Ce symbole est généralement dérivé de la forme latine du nom de l'élément, mais il peut être dérivé du nom commun largement accepté, en particulier pour les éléments les plus récents. Par exemple, le symbole pour Hélium est He, qui ressemble étroitement au nom commun. Cependant, le symbole du fer est Fe, ce qui est plus difficile à reconnaître au début.
-
 2 Recherchez le nom complet de l'élément, s'il est présent. C'est le nom de l'élément que vous utiliserez pour l'écrire. Par exemple, «Hélium» et «Carbone» sont les noms des éléments. Dans la plupart des cas, cela apparaîtra juste en dessous du symbole, mais son emplacement peut varier.[10]
2 Recherchez le nom complet de l'élément, s'il est présent. C'est le nom de l'élément que vous utiliserez pour l'écrire. Par exemple, «Hélium» et «Carbone» sont les noms des éléments. Dans la plupart des cas, cela apparaîtra juste en dessous du symbole, mais son emplacement peut varier.[10] - Certains tableaux périodiques peuvent omettre le nom complet, en utilisant uniquement le symbole.
-
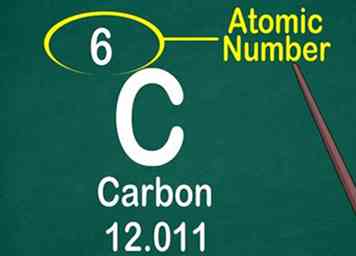 3 Trouvez le numéro atomique. Le numéro atomique est souvent situé en haut de la boîte, soit au centre, soit au coin. Cependant, il pourrait être situé sous le symbole ou le nom de l'élément. Les nombres atomiques sont séquentiels de 1 à 118.[11]
3 Trouvez le numéro atomique. Le numéro atomique est souvent situé en haut de la boîte, soit au centre, soit au coin. Cependant, il pourrait être situé sous le symbole ou le nom de l'élément. Les nombres atomiques sont séquentiels de 1 à 118.[11] - Le numéro atomique sera un nombre entier, pas un nombre décimal.
-
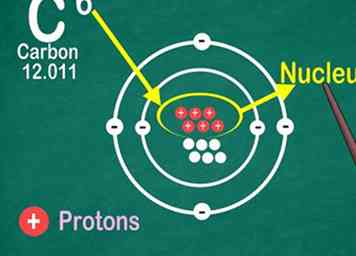 4 Reconnaître le numéro atomique est le nombre de protons dans un atome. Tous les atomes d'un élément contiennent le même nombre de protons. Contrairement aux électrons, un atome ne peut ni gagner ni perdre de protons. Sinon, l'élément changerait![12]
4 Reconnaître le numéro atomique est le nombre de protons dans un atome. Tous les atomes d'un élément contiennent le même nombre de protons. Contrairement aux électrons, un atome ne peut ni gagner ni perdre de protons. Sinon, l'élément changerait![12] - Vous utiliserez le numéro atomique pour trouver également le nombre d'électrons et de neutrons!
-
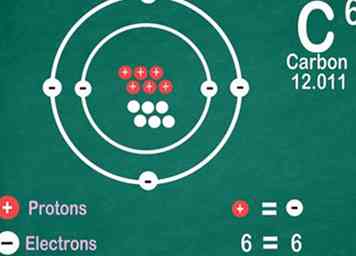 5 Les éléments connus contiennent le même nombre d'électrons que les protons. Il y a une exception s'ils sont ionisés. Les protons ont une charge positive et les électrons ont une charge négative. Comme les atomes réguliers n'ont pas de charge électrique, cela signifie que les électrons et les protons sont égaux. Cependant, un atome peut perdre ou gagner des électrons, ce qui le rend ionisé.[13]
5 Les éléments connus contiennent le même nombre d'électrons que les protons. Il y a une exception s'ils sont ionisés. Les protons ont une charge positive et les électrons ont une charge négative. Comme les atomes réguliers n'ont pas de charge électrique, cela signifie que les électrons et les protons sont égaux. Cependant, un atome peut perdre ou gagner des électrons, ce qui le rend ionisé.[13] - Les ions sont chargés électriquement. Si un ion a plus de protons, il est positif, ce qui est indiqué par un signe positif à côté du symbole de l'ion. S'il y a plus d'électrons, l'ion est négatif, ce qui est indiqué par un symbole négatif.
- Vous ne verrez pas de symbole plus ou moins si l'élément n'est pas un ion.
Troisième partie de trois:
Utilisation du poids atomique pour calculer les neutrons
-
 1 Trouvez le poids atomique. Le poids atomique apparaît généralement en bas de la boîte, sous le symbole de l'élément. Le poids atomique représente le poids combiné des particules dans le noyau, qui comprend les protons et les neutrons. Cependant, les ions compliquent le calcul, de sorte que le poids atomique représente une moyenne de la masse atomique de l'élément et de la masse atomique de ses ions.[14]
1 Trouvez le poids atomique. Le poids atomique apparaît généralement en bas de la boîte, sous le symbole de l'élément. Le poids atomique représente le poids combiné des particules dans le noyau, qui comprend les protons et les neutrons. Cependant, les ions compliquent le calcul, de sorte que le poids atomique représente une moyenne de la masse atomique de l'élément et de la masse atomique de ses ions.[14] - Comme les poids sont moyennés, la plupart des éléments auront des poids atomiques comprenant des décimales.
- Bien qu'il puisse sembler que le poids atomique augmente du nombre de gauche à droite, ce n'est pas toujours le cas.
- 2 Détermine le nombre de masse de l'élément que tu étudies. Vous pouvez trouver le nombre de masse en arrondissant la masse atomique au nombre entier le plus proche. Cela explique le fait que le poids atomique est une moyenne de toutes les masses atomiques possibles pour cet élément, y compris les ions.[15]
- Par exemple, le poids atomique du carbone est 12,011, ce qui arrondit à 12. De même, le poids du fer est 55,847, ce qui arrondit à 56.
-
 3 Soustrayez le numéro atomique du nombre de masse pour trouver les neutrons. Le nombre de masse est calculé en additionnant le nombre de protons et de neutrons. Cela vous permet de trouver facilement le nombre de neutrons dans un atome en soustrayant le nombre ou les protons du nombre de masse![16]
3 Soustrayez le numéro atomique du nombre de masse pour trouver les neutrons. Le nombre de masse est calculé en additionnant le nombre de protons et de neutrons. Cela vous permet de trouver facilement le nombre de neutrons dans un atome en soustrayant le nombre ou les protons du nombre de masse![16] - Utilisez cette formule: Neutrons = Numéro de masse - Protons
- Par exemple, le nombre de masse de Carbon est de 12 et il a 6 protons. Depuis 12 - 6 = 6, vous savez que Carbon a 6 neutrons.
- Pour un autre exemple, le nombre de masse de Iron est de 56 et il a 26 protons. Depuis 56 - 26 = 30, vous savez que Iron a 30 neutrons.
- Les isotopes d'un atome contiennent un nombre différent de neutrons, ce qui modifie le poids de l'atome.
Exemple de tableau périodique
 Exemple de tableau périodique
Exemple de tableau périodique
 Minotauromaquia
Minotauromaquia
 1 Lisez le tableau périodique de gauche à droite en haut à droite. Les éléments sont classés en fonction de leurs numéros atomiques, qui augmentent à mesure que vous vous déplacez dans le tableau périodique. Le nombre atomique est le nombre de protons que possède l'atome de l'élément. Vous remarquerez également que la masse atomique de chaque élément augmente à mesure que vous vous déplacez sur la table. Cela signifie que vous pouvez reconnaître beaucoup sur le poids d'un élément en regardant simplement sa place sur la table.
1 Lisez le tableau périodique de gauche à droite en haut à droite. Les éléments sont classés en fonction de leurs numéros atomiques, qui augmentent à mesure que vous vous déplacez dans le tableau périodique. Le nombre atomique est le nombre de protons que possède l'atome de l'élément. Vous remarquerez également que la masse atomique de chaque élément augmente à mesure que vous vous déplacez sur la table. Cela signifie que vous pouvez reconnaître beaucoup sur le poids d'un élément en regardant simplement sa place sur la table.  3 Reconnaître les groupes qui partagent des propriétés physiques et chimiques. Les groupes, également appelés familles, se trouvent dans une colonne verticale. Dans la plupart des cas, les groupes partagent également la même couleur. Cela vous aide à identifier les éléments ayant des propriétés physiques et chimiques similaires, ce qui vous permet de prévoir leur comportement.[3] Chaque élément d'un groupe particulier a le même nombre d'électrons dans son orbitale externe.[4]
3 Reconnaître les groupes qui partagent des propriétés physiques et chimiques. Les groupes, également appelés familles, se trouvent dans une colonne verticale. Dans la plupart des cas, les groupes partagent également la même couleur. Cela vous aide à identifier les éléments ayant des propriétés physiques et chimiques similaires, ce qui vous permet de prévoir leur comportement.[3] Chaque élément d'un groupe particulier a le même nombre d'électrons dans son orbitale externe.[4]  5 Notez que chaque ligne est appelée une période. Tous les éléments d'une période ont le même nombre d'orbitales atomiques, c'est là que vont leurs électrons. Le nombre d'orbitales correspondra au nombre de la période. Il y a 7 lignes, ce qui signifie qu'il y a 7 périodes.[6]
5 Notez que chaque ligne est appelée une période. Tous les éléments d'une période ont le même nombre d'orbitales atomiques, c'est là que vont leurs électrons. Le nombre d'orbitales correspondra au nombre de la période. Il y a 7 lignes, ce qui signifie qu'il y a 7 périodes.[6]  6 Distinguer les métaux, les semi-métaux et les non-métaux. Vous pouvez mieux comprendre les propriétés d'un élément en reconnaissant son type. Heureusement, la plupart des tableaux périodiques utilisent des couleurs pour indiquer si l'élément est un métal, un semi-métal ou un non-métal. Vous remarquerez que les métaux se trouvent à gauche de la table, tandis que les non-métaux tombent à droite. Les semi-métaux sont pris en sandwich entre eux.[7]
6 Distinguer les métaux, les semi-métaux et les non-métaux. Vous pouvez mieux comprendre les propriétés d'un élément en reconnaissant son type. Heureusement, la plupart des tableaux périodiques utilisent des couleurs pour indiquer si l'élément est un métal, un semi-métal ou un non-métal. Vous remarquerez que les métaux se trouvent à gauche de la table, tandis que les non-métaux tombent à droite. Les semi-métaux sont pris en sandwich entre eux.[7] 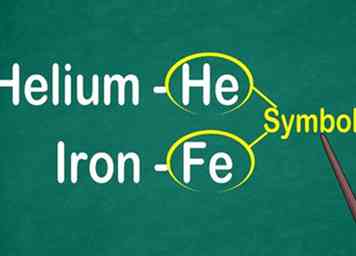 1 Reconnaître le symbole de 1 à 2 lettres de l'élément. Il apparaît le plus souvent au centre de la boîte dans une grande police. Le symbole abrégé le nom de l'élément, qui est normalisé dans différentes langues. Lorsque vous faites des expériences ou travaillez avec des équations élémentaires, vous utiliserez probablement les symboles des éléments, il est donc important de vous familiariser avec eux.[9]
1 Reconnaître le symbole de 1 à 2 lettres de l'élément. Il apparaît le plus souvent au centre de la boîte dans une grande police. Le symbole abrégé le nom de l'élément, qui est normalisé dans différentes langues. Lorsque vous faites des expériences ou travaillez avec des équations élémentaires, vous utiliserez probablement les symboles des éléments, il est donc important de vous familiariser avec eux.[9]  2 Recherchez le nom complet de l'élément, s'il est présent. C'est le nom de l'élément que vous utiliserez pour l'écrire. Par exemple, «Hélium» et «Carbone» sont les noms des éléments. Dans la plupart des cas, cela apparaîtra juste en dessous du symbole, mais son emplacement peut varier.[10]
2 Recherchez le nom complet de l'élément, s'il est présent. C'est le nom de l'élément que vous utiliserez pour l'écrire. Par exemple, «Hélium» et «Carbone» sont les noms des éléments. Dans la plupart des cas, cela apparaîtra juste en dessous du symbole, mais son emplacement peut varier.[10]  3 Trouvez le numéro atomique. Le numéro atomique est souvent situé en haut de la boîte, soit au centre, soit au coin. Cependant, il pourrait être situé sous le symbole ou le nom de l'élément. Les nombres atomiques sont séquentiels de 1 à 118.[11]
3 Trouvez le numéro atomique. Le numéro atomique est souvent situé en haut de la boîte, soit au centre, soit au coin. Cependant, il pourrait être situé sous le symbole ou le nom de l'élément. Les nombres atomiques sont séquentiels de 1 à 118.[11]  4 Reconnaître le numéro atomique est le nombre de protons dans un atome. Tous les atomes d'un élément contiennent le même nombre de protons. Contrairement aux électrons, un atome ne peut ni gagner ni perdre de protons. Sinon, l'élément changerait![12]
4 Reconnaître le numéro atomique est le nombre de protons dans un atome. Tous les atomes d'un élément contiennent le même nombre de protons. Contrairement aux électrons, un atome ne peut ni gagner ni perdre de protons. Sinon, l'élément changerait![12]  5 Les éléments connus contiennent le même nombre d'électrons que les protons. Il y a une exception s'ils sont ionisés. Les protons ont une charge positive et les électrons ont une charge négative. Comme les atomes réguliers n'ont pas de charge électrique, cela signifie que les électrons et les protons sont égaux. Cependant, un atome peut perdre ou gagner des électrons, ce qui le rend ionisé.[13]
5 Les éléments connus contiennent le même nombre d'électrons que les protons. Il y a une exception s'ils sont ionisés. Les protons ont une charge positive et les électrons ont une charge négative. Comme les atomes réguliers n'ont pas de charge électrique, cela signifie que les électrons et les protons sont égaux. Cependant, un atome peut perdre ou gagner des électrons, ce qui le rend ionisé.[13]  1 Trouvez le poids atomique. Le poids atomique apparaît généralement en bas de la boîte, sous le symbole de l'élément. Le poids atomique représente le poids combiné des particules dans le noyau, qui comprend les protons et les neutrons. Cependant, les ions compliquent le calcul, de sorte que le poids atomique représente une moyenne de la masse atomique de l'élément et de la masse atomique de ses ions.[14]
1 Trouvez le poids atomique. Le poids atomique apparaît généralement en bas de la boîte, sous le symbole de l'élément. Le poids atomique représente le poids combiné des particules dans le noyau, qui comprend les protons et les neutrons. Cependant, les ions compliquent le calcul, de sorte que le poids atomique représente une moyenne de la masse atomique de l'élément et de la masse atomique de ses ions.[14]  3 Soustrayez le numéro atomique du nombre de masse pour trouver les neutrons. Le nombre de masse est calculé en additionnant le nombre de protons et de neutrons. Cela vous permet de trouver facilement le nombre de neutrons dans un atome en soustrayant le nombre ou les protons du nombre de masse![16]
3 Soustrayez le numéro atomique du nombre de masse pour trouver les neutrons. Le nombre de masse est calculé en additionnant le nombre de protons et de neutrons. Cela vous permet de trouver facilement le nombre de neutrons dans un atome en soustrayant le nombre ou les protons du nombre de masse![16]