La corrosion est le processus par lequel le métal se dégrade en présence de divers agents oxydants dans l'environnement. Un exemple courant de ceci est le processus de rouille, pendant lequel les oxydes de fer se forment en présence d'humidité. La corrosion est un problème grave pour les fabricants de bâtiments, de bateaux, d'avions, de voitures et de la plupart des autres produits métalliques. Par exemple, lorsque du métal est utilisé comme élément d’un pont, l’intégrité structurelle de ce métal, qui peut être compromise par la corrosion, est cruciale pour la sécurité des personnes qui utilisent le pont. Voir l'étape 1 ci-dessous pour commencer à apprendre à protéger les métaux contre le risque de corrosion et à savoir comment ralentir le taux de corrosion, voir ci-dessous.
Méthode One of Three:
Comprendre les types courants de corrosion des métaux
Parce que de nombreux types de métaux sont utilisés aujourd'hui, les constructeurs et les fabricants doivent se protéger contre de nombreux types de corrosion. Chaque métal possède ses propres propriétés électrochimiques qui déterminent les types de corrosion (le cas échéant) auxquels le métal est vulnérable. Le tableau ci-dessous détaille une sélection de métaux communs et les types de corrosion qu'ils peuvent subir.
| Métal | Vulnérabilité (s) de corrosion du métal | Techniques Préventives Communes | Activité galvanique * |
|---|---|---|---|
| Acier inoxydable (passif) | Attaque uniforme, galvanique, piqûre, crevasse (tout surtout en eau salée)[1] | Nettoyage, enduit protecteur ou mastic | Faible (la corrosion initiale forme une couche d'oxyde résistante) |
| Le fer | Attaque uniforme, galvanique, crevasse | Nettoyage, enduit protecteur ou scellant, galvanisation, sol antifriction[2] | Haute |
| Laiton | Attaque uniforme, dézincification, stress | Nettoyage, enduit protecteur ou produit d'étanchéité (généralement de l'huile ou de la laque), ajout d'étain, d'aluminium ou d'arsenic aux alliages[3] | Moyen |
| Aluminium | Galvanique, piqûre, crevasse[4] | Nettoyage, enduit ou mastic de protection, anodisation, galvanisation, protection cathodique, isolation électrique [5] | Haute (la corrosion initiale forme une couche d'oxyde résistante) |
| Cuivre | Galvanique, piqûre, ternissement esthétique | Nettoyage, revêtement protecteur ou scellant, ajout de nickel à l'alliage (en particulier pour l'eau salée) | Faible (la corrosion initiale forme une patine résistante) |
* Notez que la colonne "Activité galvanique" fait référence à l'activité chimique relative du métal telle que décrite par les tableaux de séries galvaniques provenant de sources de référence.[6] Aux fins de ce tableau, plus l'activité galvanique du métal est élevée, plus il subira une corrosion galvanique lorsqu'il est associé à un métal moins actif.
-
 1 Empêcher la corrosion d'attaque uniforme en protégeant la surface métallique. La corrosion en attaque uniforme (parfois raccourcie en une corrosion "uniforme") est un type de corrosion qui se produit de manière uniforme et uniforme sur une surface métallique exposée. Dans ce type de corrosion, toute la surface du métal est attaquée par la corrosion et, par conséquent, la corrosion se produit à un rythme uniforme. Par exemple, si un toit de fer non protégé est régulièrement exposé à la pluie, toute la surface du toit sera en contact avec à peu près la même quantité d'eau et se corrodera donc à un rythme uniforme. Le moyen le plus simple de se protéger contre une corrosion d'attaque uniforme consiste généralement à placer une barrière de protection entre le métal et les agents corrosifs.[7] Cela peut être une grande variété de choses - la peinture, un mastic à l'huile, ou une solution électrochimique comme un revêtement de zinc galvanisé.
1 Empêcher la corrosion d'attaque uniforme en protégeant la surface métallique. La corrosion en attaque uniforme (parfois raccourcie en une corrosion "uniforme") est un type de corrosion qui se produit de manière uniforme et uniforme sur une surface métallique exposée. Dans ce type de corrosion, toute la surface du métal est attaquée par la corrosion et, par conséquent, la corrosion se produit à un rythme uniforme. Par exemple, si un toit de fer non protégé est régulièrement exposé à la pluie, toute la surface du toit sera en contact avec à peu près la même quantité d'eau et se corrodera donc à un rythme uniforme. Le moyen le plus simple de se protéger contre une corrosion d'attaque uniforme consiste généralement à placer une barrière de protection entre le métal et les agents corrosifs.[7] Cela peut être une grande variété de choses - la peinture, un mastic à l'huile, ou une solution électrochimique comme un revêtement de zinc galvanisé. - Dans les situations souterraines ou d'immersion, la protection cathodique est également un bon choix.[8]
-
 2 Empêcher la corrosion galvanique en stoppant le flux d'ions d'un métal à un autre. Une forme importante de corrosion pouvant survenir quelle que soit la résistance physique des métaux impliqués est la corrosion galvanique. La corrosion galvanique se produit lorsque deux métaux avec des potentiels d'électrodes différents sont en contact l'un avec l'autre en présence d'un électrolyte (comme l'eau salée) qui crée un chemin électrique conducteur entre les deux. Lorsque cela se produit, les ions métalliques s'écoulent du métal le plus actif vers le métal le moins actif, ce qui entraîne la corrosion accélérée du métal le plus actif et le ralentissement du métal moins actif. Concrètement, cela signifie que la corrosion se développera sur le métal le plus actif au point de contact entre les deux métaux.
2 Empêcher la corrosion galvanique en stoppant le flux d'ions d'un métal à un autre. Une forme importante de corrosion pouvant survenir quelle que soit la résistance physique des métaux impliqués est la corrosion galvanique. La corrosion galvanique se produit lorsque deux métaux avec des potentiels d'électrodes différents sont en contact l'un avec l'autre en présence d'un électrolyte (comme l'eau salée) qui crée un chemin électrique conducteur entre les deux. Lorsque cela se produit, les ions métalliques s'écoulent du métal le plus actif vers le métal le moins actif, ce qui entraîne la corrosion accélérée du métal le plus actif et le ralentissement du métal moins actif. Concrètement, cela signifie que la corrosion se développera sur le métal le plus actif au point de contact entre les deux métaux. - Toute méthode de protection qui empêche le flux d'ions entre les métaux peut potentiellement arrêter la corrosion galvanique. Donner aux métaux un revêtement protecteur peut aider à empêcher les électrolytes de l'environnement de créer un chemin électrique entre les deux métaux, tandis que les processus de protection électrochimique comme la galvanisation et l'anodisation fonctionnent bien. Il est également possible de contrecarrer la corrosion galvanique en isolant électriquement les zones des métaux qui entrent en contact les unes avec les autres.
- De plus, l'utilisation d'une protection cathodique ou d'une anode sacrificielle peut protéger des métaux importants de la corrosion galvanique. Voir ci-dessous pour plus d'informations.
-
 3 Empêchez la corrosion par piqûre en protégeant la surface métallique, en évitant les sources de chlorure dans l'environnement et en évitant les entailles et les rayures. La piqûre est une forme de corrosion qui se produit à l'échelle microscopique mais peut avoir des conséquences à grande échelle. Les piqûres posent un grand problème pour les métaux dont la résistance à la corrosion provient d’une mince couche de composés passifs à leur surface, car cette forme de corrosion peut entraîner des défaillances structurelles dans les situations où la couche protectrice les empêcherait normalement. La piqûre se produit lorsqu'une petite partie du métal perd sa couche passive protectrice. Lorsque cela se produit, la corrosion galvanique se produit à une échelle microscopique, entraînant la formation d'un minuscule trou dans le métal. Dans ce trou, l'environnement local devient très acide, ce qui accélère le processus. Les piqûres sont généralement évitées en appliquant un revêtement protecteur sur la surface métallique et / ou en utilisant une protection cathodique.[9]
3 Empêchez la corrosion par piqûre en protégeant la surface métallique, en évitant les sources de chlorure dans l'environnement et en évitant les entailles et les rayures. La piqûre est une forme de corrosion qui se produit à l'échelle microscopique mais peut avoir des conséquences à grande échelle. Les piqûres posent un grand problème pour les métaux dont la résistance à la corrosion provient d’une mince couche de composés passifs à leur surface, car cette forme de corrosion peut entraîner des défaillances structurelles dans les situations où la couche protectrice les empêcherait normalement. La piqûre se produit lorsqu'une petite partie du métal perd sa couche passive protectrice. Lorsque cela se produit, la corrosion galvanique se produit à une échelle microscopique, entraînant la formation d'un minuscule trou dans le métal. Dans ce trou, l'environnement local devient très acide, ce qui accélère le processus. Les piqûres sont généralement évitées en appliquant un revêtement protecteur sur la surface métallique et / ou en utilisant une protection cathodique.[9] - L'exposition à un environnement riche en chlorures (comme par exemple l'eau salée) accélère le processus de piqûre.
-
 4 Empêcher la corrosion fissurante en minimisant les espaces restreints dans la conception de l'objet. La corrosion fissurante se produit dans les espaces d'un objet en métal où l'accès au fluide environnant (air ou liquide) est faible - par exemple, sous les vis, sous les rondelles, sous les balanes ou entre les articulations d'une charnière. La corrosion des fissures se produit lorsque la fente à proximité d'une surface métallique est suffisamment large pour permettre au fluide de pénétrer, mais est suffisamment étroite pour que le fluide ait du mal à sortir et stagne. L'environnement local dans ces petits espaces devient corrosif et le métal commence à se corroder dans un processus similaire à la corrosion par piqûres. Prévenir la corrosion par crevasse est généralement un problème de conception. En minimisant la présence de vides dans la construction d'un objet en métal en fermant ces espaces ou en permettant la circulation, il est possible de minimiser la corrosion par crevasse.
4 Empêcher la corrosion fissurante en minimisant les espaces restreints dans la conception de l'objet. La corrosion fissurante se produit dans les espaces d'un objet en métal où l'accès au fluide environnant (air ou liquide) est faible - par exemple, sous les vis, sous les rondelles, sous les balanes ou entre les articulations d'une charnière. La corrosion des fissures se produit lorsque la fente à proximité d'une surface métallique est suffisamment large pour permettre au fluide de pénétrer, mais est suffisamment étroite pour que le fluide ait du mal à sortir et stagne. L'environnement local dans ces petits espaces devient corrosif et le métal commence à se corroder dans un processus similaire à la corrosion par piqûres. Prévenir la corrosion par crevasse est généralement un problème de conception. En minimisant la présence de vides dans la construction d'un objet en métal en fermant ces espaces ou en permettant la circulation, il est possible de minimiser la corrosion par crevasse. - La corrosion fissurante est particulièrement préoccupante dans le cas de métaux tels que l’aluminium, qui ont une couche extérieure passive protectrice, car le mécanisme de corrosion par crevasse peut contribuer à la dégradation de cette couche.[10]
-
 5 Prévenir la fissuration par corrosion sous contrainte en utilisant uniquement des charges sûres et / ou un recuit. La fissuration par corrosion sous contrainte (SCC) est une forme rare de défaillance structurelle liée à la corrosion qui préoccupe particulièrement les ingénieurs chargés de la construction de structures destinées à supporter des charges importantes. En cas de SCC, un métal porteur forme des fissures et des fractures en dessous de sa limite de charge spécifiée - dans des cas graves, à une fraction de la limite. En présence d'ions corrosifs, de minuscules fissures microscopiques dans le métal provoquées par la tension exercée par une charge lourde se propagent lorsque les ions corrosifs atteignent la pointe de la fissure. Cela entraîne une croissance progressive de la fissure et une éventuelle défaillance structurelle. Le SCC est particulièrement dangereux car il peut se produire même en présence de substances naturellement très peu corrosives pour le métal. Cela signifie que la corrosion dangereuse se produit alors que le reste de la surface métallique semble superficiellement non affectée.[11]
5 Prévenir la fissuration par corrosion sous contrainte en utilisant uniquement des charges sûres et / ou un recuit. La fissuration par corrosion sous contrainte (SCC) est une forme rare de défaillance structurelle liée à la corrosion qui préoccupe particulièrement les ingénieurs chargés de la construction de structures destinées à supporter des charges importantes. En cas de SCC, un métal porteur forme des fissures et des fractures en dessous de sa limite de charge spécifiée - dans des cas graves, à une fraction de la limite. En présence d'ions corrosifs, de minuscules fissures microscopiques dans le métal provoquées par la tension exercée par une charge lourde se propagent lorsque les ions corrosifs atteignent la pointe de la fissure. Cela entraîne une croissance progressive de la fissure et une éventuelle défaillance structurelle. Le SCC est particulièrement dangereux car il peut se produire même en présence de substances naturellement très peu corrosives pour le métal. Cela signifie que la corrosion dangereuse se produit alors que le reste de la surface métallique semble superficiellement non affectée.[11] - Prévenir le SCC est en partie un problème de conception. Par exemple, en choisissant un matériau résistant au SCC dans l'environnement dans lequel le métal fonctionnera et en veillant à ce que le matériau métallique soit soumis à des tests de résistance appropriés, il peut aider à prévenir le CCS. De plus, le procédé de recuit d'un métal peut éliminer les contraintes résiduelles de sa fabrication.
- SCC est connu pour être exacerbé par les températures élevées et la présence de liquide contenant des chlorures dissous.[12]
Méthode deux sur trois:
Prévention de la corrosion avec les solutions domestiques
-
 1 Peindre la surface métallique. La méthode la plus commune et la plus abordable pour protéger le métal contre la corrosion consiste peut-être à la recouvrir d'une couche de peinture. Le processus de corrosion implique l'humidité et un agent oxydant interagissant avec la surface du métal. Ainsi, lorsque le métal est revêtu d'une barrière protectrice de peinture, ni l'humidité ni les agents oxydants ne peuvent entrer en contact avec le métal lui-même et aucune corrosion ne se produit.
1 Peindre la surface métallique. La méthode la plus commune et la plus abordable pour protéger le métal contre la corrosion consiste peut-être à la recouvrir d'une couche de peinture. Le processus de corrosion implique l'humidité et un agent oxydant interagissant avec la surface du métal. Ainsi, lorsque le métal est revêtu d'une barrière protectrice de peinture, ni l'humidité ni les agents oxydants ne peuvent entrer en contact avec le métal lui-même et aucune corrosion ne se produit. - Cependant, la peinture elle-même est vulnérable à la dégradation. Réappliquez la peinture chaque fois qu'elle devient ébréchée, usée ou endommagée. Si la peinture se dégrade au point d’exposer le métal sous-jacent, assurez-vous de vérifier la présence de corrosion ou de dommages sur le métal exposé.
- Il existe une variété de méthodes pour appliquer de la peinture sur des surfaces métalliques. Les ouvriers métallurgistes utilisent souvent plusieurs de ces méthodes en conjonction pour s'assurer que tout l'objet métallique reçoit un revêtement complet. Voici un échantillon de méthodes avec des commentaires sur leurs utilisations:
- Brush - utilisé pour les espaces difficiles d'accès.
- Rouleau - utilisé pour couvrir de grandes surfaces. Pas cher et pratique.
- Air spray - utilisé pour couvrir de grandes surfaces. Plus rapide mais moins efficace que les rouleaux (le gaspillage de peinture est élevé).
- Pulvérisation sans air / Pulvérisation électrostatique sans air - utilisée pour couvrir de grandes surfaces. Rapide et permet des niveaux variables de consistance épaisse / fine. Moins de gaspillage que la pulvérisation d'air ordinaire. L'équipement est cher.
-
 2 Utilisez de la peinture marine pour le métal exposé à l'eau. Les objets en métal qui entrent régulièrement (ou constamment) en contact avec l'eau, comme les bateaux, nécessitent des peintures spéciales pour se protéger contre la possibilité accrue de corrosion. Dans ces situations, la corrosion "normale" sous forme de rouille n'est pas la seule préoccupation (bien qu'elle soit majeure), car la vie marine (bernacles, etc.) qui peut se développer sur du métal non protégé peut devenir une source supplémentaire d'usure. et la corrosion. Pour protéger des objets métalliques comme des bateaux, etc., veillez à utiliser une peinture époxy marine de haute qualité. Non seulement ces types de peinture protègent le métal sous-jacent de l'humidité, mais découragent également la croissance de la vie marine à sa surface.
2 Utilisez de la peinture marine pour le métal exposé à l'eau. Les objets en métal qui entrent régulièrement (ou constamment) en contact avec l'eau, comme les bateaux, nécessitent des peintures spéciales pour se protéger contre la possibilité accrue de corrosion. Dans ces situations, la corrosion "normale" sous forme de rouille n'est pas la seule préoccupation (bien qu'elle soit majeure), car la vie marine (bernacles, etc.) qui peut se développer sur du métal non protégé peut devenir une source supplémentaire d'usure. et la corrosion. Pour protéger des objets métalliques comme des bateaux, etc., veillez à utiliser une peinture époxy marine de haute qualité. Non seulement ces types de peinture protègent le métal sous-jacent de l'humidité, mais découragent également la croissance de la vie marine à sa surface. -
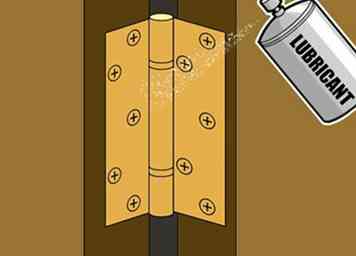 3 Appliquez des lubrifiants protecteurs sur les pièces métalliques en mouvement. Pour les surfaces métalliques plates et statiques, la peinture permet de garder l'humidité et de prévenir la corrosion sans affecter l'utilité du métal. Cependant, la peinture ne convient généralement pas pour déplacer des pièces métalliques. Par exemple, si vous peignez sur une charnière de porte, lorsque la peinture sèche, elle maintiendra la charnière en place, ce qui gênera son mouvement. Si vous forcez la porte ouverte, la peinture va se fissurer, laissant des trous pour que l'humidité atteigne le métal. Un meilleur choix pour les pièces métalliques comme les charnières, les joints, les roulements, etc., est un lubrifiant insoluble dans l'eau. Une couche complète de ce type de lubrifiant repousse naturellement l'humidité tout en assurant le mouvement facile et en douceur de votre pièce métallique.
3 Appliquez des lubrifiants protecteurs sur les pièces métalliques en mouvement. Pour les surfaces métalliques plates et statiques, la peinture permet de garder l'humidité et de prévenir la corrosion sans affecter l'utilité du métal. Cependant, la peinture ne convient généralement pas pour déplacer des pièces métalliques. Par exemple, si vous peignez sur une charnière de porte, lorsque la peinture sèche, elle maintiendra la charnière en place, ce qui gênera son mouvement. Si vous forcez la porte ouverte, la peinture va se fissurer, laissant des trous pour que l'humidité atteigne le métal. Un meilleur choix pour les pièces métalliques comme les charnières, les joints, les roulements, etc., est un lubrifiant insoluble dans l'eau. Une couche complète de ce type de lubrifiant repousse naturellement l'humidité tout en assurant le mouvement facile et en douceur de votre pièce métallique. - Comme les lubrifiants ne sèchent pas comme les peintures, ils se dégradent avec le temps et nécessitent une réapplication occasionnelle. Réappliquer périodiquement les lubrifiants sur les pièces métalliques pour garantir leur efficacité en tant que produits d'étanchéité protecteurs.
-
 4 Nettoyez soigneusement les surfaces métalliques avant de peindre ou de lubrifier. Que vous utilisiez une peinture normale, une peinture marine ou un lubrifiant / scellant protecteur, vous devez vous assurer que votre métal est propre et sec avant de commencer le processus d'application. Veillez à ce que le métal soit entièrement exempt de saleté, de graisse, de débris de soudage résiduels ou de corrosion existante, car ces éléments peuvent nuire à vos efforts en contribuant à la corrosion future.
4 Nettoyez soigneusement les surfaces métalliques avant de peindre ou de lubrifier. Que vous utilisiez une peinture normale, une peinture marine ou un lubrifiant / scellant protecteur, vous devez vous assurer que votre métal est propre et sec avant de commencer le processus d'application. Veillez à ce que le métal soit entièrement exempt de saleté, de graisse, de débris de soudage résiduels ou de corrosion existante, car ces éléments peuvent nuire à vos efforts en contribuant à la corrosion future. - La saleté, la crasse et autres débris interfèrent avec la peinture et les lubrifiants en empêchant la peinture ou le lubrifiant d'adhérer directement à la surface métallique. Par exemple, si vous peignez au-dessus d'une feuille d'acier avec quelques copeaux de métal égarés, la peinture se déposera sur les copeaux, laissant des espaces vides sur le métal sous-jacent. Si et quand les copeaux tombent, le point exposé sera vulnérable à la corrosion.
- Si vous peignez ou lubrifiez une surface métallique avec de la corrosion existante, votre objectif devrait être de rendre la surface aussi lisse et régulière que possible afin d’assurer la meilleure adhérence possible du scellant au métal. Utilisez une brosse métallique, du papier de verre et / ou un produit antirouille chimique pour éliminer autant de corrosion que possible.
-
 5 Conservez les produits métalliques non protégés à l'abri de l'humidité. Comme indiqué ci-dessus, la plupart des formes de corrosion sont aggravées par l'humidité. Si vous ne parvenez pas à donner à votre métal une couche protectrice de peinture ou de mastic, veillez à ce qu'il ne soit pas exposé à l'humidité. Faire un effort pour garder les outils métalliques non protégés peut améliorer leur utilité et prolonger leur durée de vie. Si vos objets métalliques sont exposés à l'eau ou à l'humidité, assurez-vous de les nettoyer et de les sécher immédiatement après utilisation.
5 Conservez les produits métalliques non protégés à l'abri de l'humidité. Comme indiqué ci-dessus, la plupart des formes de corrosion sont aggravées par l'humidité. Si vous ne parvenez pas à donner à votre métal une couche protectrice de peinture ou de mastic, veillez à ce qu'il ne soit pas exposé à l'humidité. Faire un effort pour garder les outils métalliques non protégés peut améliorer leur utilité et prolonger leur durée de vie. Si vos objets métalliques sont exposés à l'eau ou à l'humidité, assurez-vous de les nettoyer et de les sécher immédiatement après utilisation. - En plus de surveiller l'exposition à l'humidité pendant l'utilisation, veillez à stocker les objets métalliques à l'intérieur dans un endroit propre et sec. Pour les gros objets qui ne rentrent pas dans une armoire ou un placard, couvrez l’objet avec une bâche ou un tissu. Cela aide à garder l'humidité de l'air et empêche la poussière de s'accumuler sur la surface.
-
 6 Gardez les surfaces métalliques aussi propres que possible. Après chaque utilisation d'un objet en métal, que le métal soit peint ou non, assurez-vous de nettoyer ses surfaces fonctionnelles, en éliminant la saleté, la crasse ou la poussière. L'accumulation de saleté et de débris sur la surface métallique peut contribuer à l'usure et à l'oreille du métal et / ou de son revêtement protecteur, entraînant une corrosion au fil du temps.
6 Gardez les surfaces métalliques aussi propres que possible. Après chaque utilisation d'un objet en métal, que le métal soit peint ou non, assurez-vous de nettoyer ses surfaces fonctionnelles, en éliminant la saleté, la crasse ou la poussière. L'accumulation de saleté et de débris sur la surface métallique peut contribuer à l'usure et à l'oreille du métal et / ou de son revêtement protecteur, entraînant une corrosion au fil du temps.
Méthode trois sur trois:
Prévention de la corrosion avec des solutions électrochimiques avancées
-
 1 Utilisez un processus de galvanisation. Galvanisé Le métal est un métal recouvert d'une fine couche de zinc pour le protéger de la corrosion. Le zinc est plus actif chimiquement que le métal sous-jacent[13], donc il s'oxyde lorsqu'il est exposé à l'air. Une fois la couche de zinc oxydée, elle forme un revêtement protecteur empêchant toute corrosion ultérieure du métal. Le type de galvanisation le plus courant aujourd'hui est un procédé appelé galvanisation à chaud dans lequel des pièces métalliques (généralement de l'acier) sont immergées dans une cuve de zinc fondu chaud afin d'obtenir un revêtement uniforme.
1 Utilisez un processus de galvanisation. Galvanisé Le métal est un métal recouvert d'une fine couche de zinc pour le protéger de la corrosion. Le zinc est plus actif chimiquement que le métal sous-jacent[13], donc il s'oxyde lorsqu'il est exposé à l'air. Une fois la couche de zinc oxydée, elle forme un revêtement protecteur empêchant toute corrosion ultérieure du métal. Le type de galvanisation le plus courant aujourd'hui est un procédé appelé galvanisation à chaud dans lequel des pièces métalliques (généralement de l'acier) sont immergées dans une cuve de zinc fondu chaud afin d'obtenir un revêtement uniforme. - Ce processus implique la manipulation de produits chimiques industriels, dont certains sont dangereux à température ambiante, à des températures extrêmement élevées et ne devrait donc être tenté que par des professionnels formés. Voici les étapes de base du processus de galvanisation à chaud de l'acier:
- L'acier est nettoyé avec une solution caustique pour éliminer la saleté, la graisse, la peinture, etc., puis rincé à fond.
- L'acier est décapé dans de l'acide pour éliminer le tartre, puis rincé.
- Un matériau appelé un flux est appliqué sur l'acier et laissé sécher. Cela aide le revêtement de zinc final à adhérer à l'acier.
- L'acier est trempé dans une cuve de zinc en fusion et laissé chauffer à la température du zinc.
- L'acier est refroidi dans un "réservoir de trempe" contenant de l'eau.
- Ce processus implique la manipulation de produits chimiques industriels, dont certains sont dangereux à température ambiante, à des températures extrêmement élevées et ne devrait donc être tenté que par des professionnels formés. Voici les étapes de base du processus de galvanisation à chaud de l'acier:
-
 2 Utilisez une anode sacrificielle. Une manière de protéger un objet métallique de la corrosion consiste à fixer électriquement un petit morceau de métal réactif appelé anode sacrificielle à elle. En raison de la relation électrochimique entre le plus gros objet métallique et le petit objet réactif (expliqué brièvement ci-dessous), seul le petit morceau de métal réactif subira une corrosion, laissant le gros objet métallique important intact. Lorsque l'anode sacrificielle se corrode complètement, elle doit être remplacée ou l'objet en métal plus gros commence à se corroder. Cette méthode de protection contre la corrosion est souvent utilisée pour les structures enterrées, telles que les réservoirs de stockage souterrains, ou les objets en contact permanent avec l'eau, comme les bateaux.
2 Utilisez une anode sacrificielle. Une manière de protéger un objet métallique de la corrosion consiste à fixer électriquement un petit morceau de métal réactif appelé anode sacrificielle à elle. En raison de la relation électrochimique entre le plus gros objet métallique et le petit objet réactif (expliqué brièvement ci-dessous), seul le petit morceau de métal réactif subira une corrosion, laissant le gros objet métallique important intact. Lorsque l'anode sacrificielle se corrode complètement, elle doit être remplacée ou l'objet en métal plus gros commence à se corroder. Cette méthode de protection contre la corrosion est souvent utilisée pour les structures enterrées, telles que les réservoirs de stockage souterrains, ou les objets en contact permanent avec l'eau, comme les bateaux. - Les anodes sacrificielles sont fabriquées à partir de plusieurs types différents de métal réactif. Le zinc, l'aluminium et le magnésium sont trois des métaux les plus couramment utilisés à cette fin. En raison des propriétés chimiques de ces matériaux, le zinc et l’aluminium sont souvent utilisés pour les objets métalliques dans l’eau salée, tandis que le magnésium convient mieux à l’eau douce.
- La raison pour laquelle une anode sacrificielle fonctionne est liée à la chimie du processus de corrosion proprement dit. Lorsqu'un objet métallique se corrode, des zones qui ressemblent chimiquement aux anodes et aux cathodes d'une cellule électrochimique se forment naturellement. Les électrons s'écoulent des parties les plus anodiques de la surface métallique dans les électrolytes environnants. Comme les anodes sacrificielles sont très réactives par rapport au métal de l'objet à protéger, l'objet lui-même devient très cathodique en comparaison et ainsi, les électrons sortent de l'anode sacrificielle, la corrodant mais épargnant le reste du métal.
-
 3 Utilisez un courant imposé. Parce que le processus chimique à l'origine de la corrosion des métaux implique un courant électrique sous la forme d'électrons sortant du métal, il est possible d'utiliser une source extérieure de courant électrique pour maîtriser le courant corrosif et empêcher la corrosion. Essentiellement, ce processus (appelé courant imposé) confère une charge électrique négative continue au métal à protéger.Cette charge surpasse le courant, provoquant la sortie des électrons du métal, stoppant la corrosion. Ce type de protection est souvent utilisé pour les structures métalliques enterrées telles que les réservoirs de stockage et les pipelines.
3 Utilisez un courant imposé. Parce que le processus chimique à l'origine de la corrosion des métaux implique un courant électrique sous la forme d'électrons sortant du métal, il est possible d'utiliser une source extérieure de courant électrique pour maîtriser le courant corrosif et empêcher la corrosion. Essentiellement, ce processus (appelé courant imposé) confère une charge électrique négative continue au métal à protéger.Cette charge surpasse le courant, provoquant la sortie des électrons du métal, stoppant la corrosion. Ce type de protection est souvent utilisé pour les structures métalliques enterrées telles que les réservoirs de stockage et les pipelines. - Notez que le type de courant utilisé pour les systèmes de protection à courant imposé est généralement le courant continu (DC).
- Généralement, le courant imprimé anti-corrosion est généré en enfouissant deux anodes métalliques dans le sol près de l'objet métallique à protéger. Le courant est envoyé aux anodes par un fil isolé, qui circule ensuite dans le sol et dans l'objet métallique. Le courant traverse l'objet métallique et retourne à la source de courant (générateur, redresseur, etc.) via un fil isolé. [14]
-
 4 Utilisez l'anodisation. L'anodisation est un type spécial de revêtement de surface protecteur utilisé pour protéger le métal de la corrosion et également pour appliquer des matrices, etc. Si vous avez déjà vu un mousqueton en métal de couleur vive, vous avez vu une surface métallique anodisée teinte. Plutôt que d’appliquer l’application physique d’un revêtement protecteur, comme dans le cas de la peinture, l’anodisation utilise un courant électrique pour donner au métal un revêtement protecteur qui prévient presque toutes les formes de corrosion.
4 Utilisez l'anodisation. L'anodisation est un type spécial de revêtement de surface protecteur utilisé pour protéger le métal de la corrosion et également pour appliquer des matrices, etc. Si vous avez déjà vu un mousqueton en métal de couleur vive, vous avez vu une surface métallique anodisée teinte. Plutôt que d’appliquer l’application physique d’un revêtement protecteur, comme dans le cas de la peinture, l’anodisation utilise un courant électrique pour donner au métal un revêtement protecteur qui prévient presque toutes les formes de corrosion. - Le processus chimique à l'origine de l'anodisation implique le fait que de nombreux métaux, comme l'aluminium, forment naturellement des produits chimiques appelés oxydes lorsqu'ils entrent en contact avec l'oxygène de l'air. Il en résulte que le métal a normalement une mince couche d'oxyde externe qui protège (à divers degrés, en fonction du métal) contre la corrosion. Le courant électrique utilisé dans le processus d'anodisation crée essentiellement une accumulation beaucoup plus épaisse de cet oxyde sur la surface du métal que ce qui se produirait normalement, offrant une grande protection contre la corrosion.
- Il existe plusieurs façons d’anodiser les métaux. Vous trouverez ci-dessous les étapes de base d'un processus d'anodisation.[15] Voir Comment anodiser l'aluminium pour plus d'informations.
- L'aluminium est nettoyé et dégraissé.
- Les impuretés de surface de l'aluminium sont éliminées avec une solution de désinsectisation.
- L'aluminium est abaissé dans un bain d'acide à un courant et à une température constants (par exemple, 12 ampères / pieds carrés et 70-72 degrés F (21-22 degrés C).
- L'aluminium est enlevé et rincé.
- L'aluminium est éventuellement immergé dans un colorant à 100-140 degrés F (38-60 degrés C).
- L'aluminium est scellé en le plaçant dans de l'eau bouillante pendant 20-30 minutes.
-
 5 Utilisez un métal qui présente une passivation. Comme indiqué ci-dessus, certains métaux forment naturellement un revêtement d'oxyde protecteur lors d'une exposition à l'air. Certains métaux forment ce revêtement d'oxyde si efficacement qu'ils finissent par devenir relativement inactifs chimiquement. Nous disons que ces métaux sont passif en référence au processus de passivation par lequel ils deviennent moins réactifs. Selon son utilisation souhaitée, un objet en métal passif peut ne pas nécessairement avoir besoin toute protection supplémentaire pour le rendre résistant à la corrosion.
5 Utilisez un métal qui présente une passivation. Comme indiqué ci-dessus, certains métaux forment naturellement un revêtement d'oxyde protecteur lors d'une exposition à l'air. Certains métaux forment ce revêtement d'oxyde si efficacement qu'ils finissent par devenir relativement inactifs chimiquement. Nous disons que ces métaux sont passif en référence au processus de passivation par lequel ils deviennent moins réactifs. Selon son utilisation souhaitée, un objet en métal passif peut ne pas nécessairement avoir besoin toute protection supplémentaire pour le rendre résistant à la corrosion. - Un exemple bien connu d'un métal qui présente une passivation est l'acier inoxydable. L'acier inoxydable est un alliage d'acier ordinaire et de chrome qui résiste efficacement à la corrosion dans la plupart des conditions sans nécessiter aucune autre protection. Pour la plupart des utilisations quotidiennes, la corrosion n'est généralement pas un problème avec l'acier inoxydable.
- Toutefois, il convient de mentionner que dans certaines conditions, l’acier inoxydable n’est pas à 100% résistant à la corrosion, notamment dans l’eau salée. De même, de nombreux métaux passifs deviennent non passifs dans certaines conditions extrêmes et peuvent donc ne pas convenir à toutes les utilisations.
- Un exemple bien connu d'un métal qui présente une passivation est l'acier inoxydable. L'acier inoxydable est un alliage d'acier ordinaire et de chrome qui résiste efficacement à la corrosion dans la plupart des conditions sans nécessiter aucune autre protection. Pour la plupart des utilisations quotidiennes, la corrosion n'est généralement pas un problème avec l'acier inoxydable.
 Minotauromaquia
Minotauromaquia
 1 Empêcher la corrosion d'attaque uniforme en protégeant la surface métallique. La corrosion en attaque uniforme (parfois raccourcie en une corrosion "uniforme") est un type de corrosion qui se produit de manière uniforme et uniforme sur une surface métallique exposée. Dans ce type de corrosion, toute la surface du métal est attaquée par la corrosion et, par conséquent, la corrosion se produit à un rythme uniforme. Par exemple, si un toit de fer non protégé est régulièrement exposé à la pluie, toute la surface du toit sera en contact avec à peu près la même quantité d'eau et se corrodera donc à un rythme uniforme. Le moyen le plus simple de se protéger contre une corrosion d'attaque uniforme consiste généralement à placer une barrière de protection entre le métal et les agents corrosifs.[7] Cela peut être une grande variété de choses - la peinture, un mastic à l'huile, ou une solution électrochimique comme un revêtement de zinc galvanisé.
1 Empêcher la corrosion d'attaque uniforme en protégeant la surface métallique. La corrosion en attaque uniforme (parfois raccourcie en une corrosion "uniforme") est un type de corrosion qui se produit de manière uniforme et uniforme sur une surface métallique exposée. Dans ce type de corrosion, toute la surface du métal est attaquée par la corrosion et, par conséquent, la corrosion se produit à un rythme uniforme. Par exemple, si un toit de fer non protégé est régulièrement exposé à la pluie, toute la surface du toit sera en contact avec à peu près la même quantité d'eau et se corrodera donc à un rythme uniforme. Le moyen le plus simple de se protéger contre une corrosion d'attaque uniforme consiste généralement à placer une barrière de protection entre le métal et les agents corrosifs.[7] Cela peut être une grande variété de choses - la peinture, un mastic à l'huile, ou une solution électrochimique comme un revêtement de zinc galvanisé.  2 Empêcher la corrosion galvanique en stoppant le flux d'ions d'un métal à un autre. Une forme importante de corrosion pouvant survenir quelle que soit la résistance physique des métaux impliqués est la corrosion galvanique. La corrosion galvanique se produit lorsque deux métaux avec des potentiels d'électrodes différents sont en contact l'un avec l'autre en présence d'un électrolyte (comme l'eau salée) qui crée un chemin électrique conducteur entre les deux. Lorsque cela se produit, les ions métalliques s'écoulent du métal le plus actif vers le métal le moins actif, ce qui entraîne la corrosion accélérée du métal le plus actif et le ralentissement du métal moins actif. Concrètement, cela signifie que la corrosion se développera sur le métal le plus actif au point de contact entre les deux métaux.
2 Empêcher la corrosion galvanique en stoppant le flux d'ions d'un métal à un autre. Une forme importante de corrosion pouvant survenir quelle que soit la résistance physique des métaux impliqués est la corrosion galvanique. La corrosion galvanique se produit lorsque deux métaux avec des potentiels d'électrodes différents sont en contact l'un avec l'autre en présence d'un électrolyte (comme l'eau salée) qui crée un chemin électrique conducteur entre les deux. Lorsque cela se produit, les ions métalliques s'écoulent du métal le plus actif vers le métal le moins actif, ce qui entraîne la corrosion accélérée du métal le plus actif et le ralentissement du métal moins actif. Concrètement, cela signifie que la corrosion se développera sur le métal le plus actif au point de contact entre les deux métaux.  3 Empêchez la corrosion par piqûre en protégeant la surface métallique, en évitant les sources de chlorure dans l'environnement et en évitant les entailles et les rayures. La piqûre est une forme de corrosion qui se produit à l'échelle microscopique mais peut avoir des conséquences à grande échelle. Les piqûres posent un grand problème pour les métaux dont la résistance à la corrosion provient d’une mince couche de composés passifs à leur surface, car cette forme de corrosion peut entraîner des défaillances structurelles dans les situations où la couche protectrice les empêcherait normalement. La piqûre se produit lorsqu'une petite partie du métal perd sa couche passive protectrice. Lorsque cela se produit, la corrosion galvanique se produit à une échelle microscopique, entraînant la formation d'un minuscule trou dans le métal. Dans ce trou, l'environnement local devient très acide, ce qui accélère le processus. Les piqûres sont généralement évitées en appliquant un revêtement protecteur sur la surface métallique et / ou en utilisant une protection cathodique.[9]
3 Empêchez la corrosion par piqûre en protégeant la surface métallique, en évitant les sources de chlorure dans l'environnement et en évitant les entailles et les rayures. La piqûre est une forme de corrosion qui se produit à l'échelle microscopique mais peut avoir des conséquences à grande échelle. Les piqûres posent un grand problème pour les métaux dont la résistance à la corrosion provient d’une mince couche de composés passifs à leur surface, car cette forme de corrosion peut entraîner des défaillances structurelles dans les situations où la couche protectrice les empêcherait normalement. La piqûre se produit lorsqu'une petite partie du métal perd sa couche passive protectrice. Lorsque cela se produit, la corrosion galvanique se produit à une échelle microscopique, entraînant la formation d'un minuscule trou dans le métal. Dans ce trou, l'environnement local devient très acide, ce qui accélère le processus. Les piqûres sont généralement évitées en appliquant un revêtement protecteur sur la surface métallique et / ou en utilisant une protection cathodique.[9]  4 Empêcher la corrosion fissurante en minimisant les espaces restreints dans la conception de l'objet. La corrosion fissurante se produit dans les espaces d'un objet en métal où l'accès au fluide environnant (air ou liquide) est faible - par exemple, sous les vis, sous les rondelles, sous les balanes ou entre les articulations d'une charnière. La corrosion des fissures se produit lorsque la fente à proximité d'une surface métallique est suffisamment large pour permettre au fluide de pénétrer, mais est suffisamment étroite pour que le fluide ait du mal à sortir et stagne. L'environnement local dans ces petits espaces devient corrosif et le métal commence à se corroder dans un processus similaire à la corrosion par piqûres. Prévenir la corrosion par crevasse est généralement un problème de conception. En minimisant la présence de vides dans la construction d'un objet en métal en fermant ces espaces ou en permettant la circulation, il est possible de minimiser la corrosion par crevasse.
4 Empêcher la corrosion fissurante en minimisant les espaces restreints dans la conception de l'objet. La corrosion fissurante se produit dans les espaces d'un objet en métal où l'accès au fluide environnant (air ou liquide) est faible - par exemple, sous les vis, sous les rondelles, sous les balanes ou entre les articulations d'une charnière. La corrosion des fissures se produit lorsque la fente à proximité d'une surface métallique est suffisamment large pour permettre au fluide de pénétrer, mais est suffisamment étroite pour que le fluide ait du mal à sortir et stagne. L'environnement local dans ces petits espaces devient corrosif et le métal commence à se corroder dans un processus similaire à la corrosion par piqûres. Prévenir la corrosion par crevasse est généralement un problème de conception. En minimisant la présence de vides dans la construction d'un objet en métal en fermant ces espaces ou en permettant la circulation, il est possible de minimiser la corrosion par crevasse.  5 Prévenir la fissuration par corrosion sous contrainte en utilisant uniquement des charges sûres et / ou un recuit. La fissuration par corrosion sous contrainte (SCC) est une forme rare de défaillance structurelle liée à la corrosion qui préoccupe particulièrement les ingénieurs chargés de la construction de structures destinées à supporter des charges importantes. En cas de SCC, un métal porteur forme des fissures et des fractures en dessous de sa limite de charge spécifiée - dans des cas graves, à une fraction de la limite. En présence d'ions corrosifs, de minuscules fissures microscopiques dans le métal provoquées par la tension exercée par une charge lourde se propagent lorsque les ions corrosifs atteignent la pointe de la fissure. Cela entraîne une croissance progressive de la fissure et une éventuelle défaillance structurelle. Le SCC est particulièrement dangereux car il peut se produire même en présence de substances naturellement très peu corrosives pour le métal. Cela signifie que la corrosion dangereuse se produit alors que le reste de la surface métallique semble superficiellement non affectée.[11]
5 Prévenir la fissuration par corrosion sous contrainte en utilisant uniquement des charges sûres et / ou un recuit. La fissuration par corrosion sous contrainte (SCC) est une forme rare de défaillance structurelle liée à la corrosion qui préoccupe particulièrement les ingénieurs chargés de la construction de structures destinées à supporter des charges importantes. En cas de SCC, un métal porteur forme des fissures et des fractures en dessous de sa limite de charge spécifiée - dans des cas graves, à une fraction de la limite. En présence d'ions corrosifs, de minuscules fissures microscopiques dans le métal provoquées par la tension exercée par une charge lourde se propagent lorsque les ions corrosifs atteignent la pointe de la fissure. Cela entraîne une croissance progressive de la fissure et une éventuelle défaillance structurelle. Le SCC est particulièrement dangereux car il peut se produire même en présence de substances naturellement très peu corrosives pour le métal. Cela signifie que la corrosion dangereuse se produit alors que le reste de la surface métallique semble superficiellement non affectée.[11]  1 Peindre la surface métallique. La méthode la plus commune et la plus abordable pour protéger le métal contre la corrosion consiste peut-être à la recouvrir d'une couche de peinture. Le processus de corrosion implique l'humidité et un agent oxydant interagissant avec la surface du métal. Ainsi, lorsque le métal est revêtu d'une barrière protectrice de peinture, ni l'humidité ni les agents oxydants ne peuvent entrer en contact avec le métal lui-même et aucune corrosion ne se produit.
1 Peindre la surface métallique. La méthode la plus commune et la plus abordable pour protéger le métal contre la corrosion consiste peut-être à la recouvrir d'une couche de peinture. Le processus de corrosion implique l'humidité et un agent oxydant interagissant avec la surface du métal. Ainsi, lorsque le métal est revêtu d'une barrière protectrice de peinture, ni l'humidité ni les agents oxydants ne peuvent entrer en contact avec le métal lui-même et aucune corrosion ne se produit.  2 Utilisez de la peinture marine pour le métal exposé à l'eau. Les objets en métal qui entrent régulièrement (ou constamment) en contact avec l'eau, comme les bateaux, nécessitent des peintures spéciales pour se protéger contre la possibilité accrue de corrosion. Dans ces situations, la corrosion "normale" sous forme de rouille n'est pas la seule préoccupation (bien qu'elle soit majeure), car la vie marine (bernacles, etc.) qui peut se développer sur du métal non protégé peut devenir une source supplémentaire d'usure. et la corrosion. Pour protéger des objets métalliques comme des bateaux, etc., veillez à utiliser une peinture époxy marine de haute qualité. Non seulement ces types de peinture protègent le métal sous-jacent de l'humidité, mais découragent également la croissance de la vie marine à sa surface.
2 Utilisez de la peinture marine pour le métal exposé à l'eau. Les objets en métal qui entrent régulièrement (ou constamment) en contact avec l'eau, comme les bateaux, nécessitent des peintures spéciales pour se protéger contre la possibilité accrue de corrosion. Dans ces situations, la corrosion "normale" sous forme de rouille n'est pas la seule préoccupation (bien qu'elle soit majeure), car la vie marine (bernacles, etc.) qui peut se développer sur du métal non protégé peut devenir une source supplémentaire d'usure. et la corrosion. Pour protéger des objets métalliques comme des bateaux, etc., veillez à utiliser une peinture époxy marine de haute qualité. Non seulement ces types de peinture protègent le métal sous-jacent de l'humidité, mais découragent également la croissance de la vie marine à sa surface.  3 Appliquez des lubrifiants protecteurs sur les pièces métalliques en mouvement. Pour les surfaces métalliques plates et statiques, la peinture permet de garder l'humidité et de prévenir la corrosion sans affecter l'utilité du métal. Cependant, la peinture ne convient généralement pas pour déplacer des pièces métalliques. Par exemple, si vous peignez sur une charnière de porte, lorsque la peinture sèche, elle maintiendra la charnière en place, ce qui gênera son mouvement. Si vous forcez la porte ouverte, la peinture va se fissurer, laissant des trous pour que l'humidité atteigne le métal. Un meilleur choix pour les pièces métalliques comme les charnières, les joints, les roulements, etc., est un lubrifiant insoluble dans l'eau. Une couche complète de ce type de lubrifiant repousse naturellement l'humidité tout en assurant le mouvement facile et en douceur de votre pièce métallique.
3 Appliquez des lubrifiants protecteurs sur les pièces métalliques en mouvement. Pour les surfaces métalliques plates et statiques, la peinture permet de garder l'humidité et de prévenir la corrosion sans affecter l'utilité du métal. Cependant, la peinture ne convient généralement pas pour déplacer des pièces métalliques. Par exemple, si vous peignez sur une charnière de porte, lorsque la peinture sèche, elle maintiendra la charnière en place, ce qui gênera son mouvement. Si vous forcez la porte ouverte, la peinture va se fissurer, laissant des trous pour que l'humidité atteigne le métal. Un meilleur choix pour les pièces métalliques comme les charnières, les joints, les roulements, etc., est un lubrifiant insoluble dans l'eau. Une couche complète de ce type de lubrifiant repousse naturellement l'humidité tout en assurant le mouvement facile et en douceur de votre pièce métallique.  4 Nettoyez soigneusement les surfaces métalliques avant de peindre ou de lubrifier. Que vous utilisiez une peinture normale, une peinture marine ou un lubrifiant / scellant protecteur, vous devez vous assurer que votre métal est propre et sec avant de commencer le processus d'application. Veillez à ce que le métal soit entièrement exempt de saleté, de graisse, de débris de soudage résiduels ou de corrosion existante, car ces éléments peuvent nuire à vos efforts en contribuant à la corrosion future.
4 Nettoyez soigneusement les surfaces métalliques avant de peindre ou de lubrifier. Que vous utilisiez une peinture normale, une peinture marine ou un lubrifiant / scellant protecteur, vous devez vous assurer que votre métal est propre et sec avant de commencer le processus d'application. Veillez à ce que le métal soit entièrement exempt de saleté, de graisse, de débris de soudage résiduels ou de corrosion existante, car ces éléments peuvent nuire à vos efforts en contribuant à la corrosion future.  5 Conservez les produits métalliques non protégés à l'abri de l'humidité. Comme indiqué ci-dessus, la plupart des formes de corrosion sont aggravées par l'humidité. Si vous ne parvenez pas à donner à votre métal une couche protectrice de peinture ou de mastic, veillez à ce qu'il ne soit pas exposé à l'humidité. Faire un effort pour garder les outils métalliques non protégés peut améliorer leur utilité et prolonger leur durée de vie. Si vos objets métalliques sont exposés à l'eau ou à l'humidité, assurez-vous de les nettoyer et de les sécher immédiatement après utilisation.
5 Conservez les produits métalliques non protégés à l'abri de l'humidité. Comme indiqué ci-dessus, la plupart des formes de corrosion sont aggravées par l'humidité. Si vous ne parvenez pas à donner à votre métal une couche protectrice de peinture ou de mastic, veillez à ce qu'il ne soit pas exposé à l'humidité. Faire un effort pour garder les outils métalliques non protégés peut améliorer leur utilité et prolonger leur durée de vie. Si vos objets métalliques sont exposés à l'eau ou à l'humidité, assurez-vous de les nettoyer et de les sécher immédiatement après utilisation.  6 Gardez les surfaces métalliques aussi propres que possible. Après chaque utilisation d'un objet en métal, que le métal soit peint ou non, assurez-vous de nettoyer ses surfaces fonctionnelles, en éliminant la saleté, la crasse ou la poussière. L'accumulation de saleté et de débris sur la surface métallique peut contribuer à l'usure et à l'oreille du métal et / ou de son revêtement protecteur, entraînant une corrosion au fil du temps.
6 Gardez les surfaces métalliques aussi propres que possible. Après chaque utilisation d'un objet en métal, que le métal soit peint ou non, assurez-vous de nettoyer ses surfaces fonctionnelles, en éliminant la saleté, la crasse ou la poussière. L'accumulation de saleté et de débris sur la surface métallique peut contribuer à l'usure et à l'oreille du métal et / ou de son revêtement protecteur, entraînant une corrosion au fil du temps.  1 Utilisez un processus de galvanisation. Galvanisé Le métal est un métal recouvert d'une fine couche de zinc pour le protéger de la corrosion. Le zinc est plus actif chimiquement que le métal sous-jacent[13], donc il s'oxyde lorsqu'il est exposé à l'air. Une fois la couche de zinc oxydée, elle forme un revêtement protecteur empêchant toute corrosion ultérieure du métal. Le type de galvanisation le plus courant aujourd'hui est un procédé appelé galvanisation à chaud dans lequel des pièces métalliques (généralement de l'acier) sont immergées dans une cuve de zinc fondu chaud afin d'obtenir un revêtement uniforme.
1 Utilisez un processus de galvanisation. Galvanisé Le métal est un métal recouvert d'une fine couche de zinc pour le protéger de la corrosion. Le zinc est plus actif chimiquement que le métal sous-jacent[13], donc il s'oxyde lorsqu'il est exposé à l'air. Une fois la couche de zinc oxydée, elle forme un revêtement protecteur empêchant toute corrosion ultérieure du métal. Le type de galvanisation le plus courant aujourd'hui est un procédé appelé galvanisation à chaud dans lequel des pièces métalliques (généralement de l'acier) sont immergées dans une cuve de zinc fondu chaud afin d'obtenir un revêtement uniforme.  2 Utilisez une anode sacrificielle. Une manière de protéger un objet métallique de la corrosion consiste à fixer électriquement un petit morceau de métal réactif appelé anode sacrificielle à elle. En raison de la relation électrochimique entre le plus gros objet métallique et le petit objet réactif (expliqué brièvement ci-dessous), seul le petit morceau de métal réactif subira une corrosion, laissant le gros objet métallique important intact. Lorsque l'anode sacrificielle se corrode complètement, elle doit être remplacée ou l'objet en métal plus gros commence à se corroder. Cette méthode de protection contre la corrosion est souvent utilisée pour les structures enterrées, telles que les réservoirs de stockage souterrains, ou les objets en contact permanent avec l'eau, comme les bateaux.
2 Utilisez une anode sacrificielle. Une manière de protéger un objet métallique de la corrosion consiste à fixer électriquement un petit morceau de métal réactif appelé anode sacrificielle à elle. En raison de la relation électrochimique entre le plus gros objet métallique et le petit objet réactif (expliqué brièvement ci-dessous), seul le petit morceau de métal réactif subira une corrosion, laissant le gros objet métallique important intact. Lorsque l'anode sacrificielle se corrode complètement, elle doit être remplacée ou l'objet en métal plus gros commence à se corroder. Cette méthode de protection contre la corrosion est souvent utilisée pour les structures enterrées, telles que les réservoirs de stockage souterrains, ou les objets en contact permanent avec l'eau, comme les bateaux.  3 Utilisez un courant imposé. Parce que le processus chimique à l'origine de la corrosion des métaux implique un courant électrique sous la forme d'électrons sortant du métal, il est possible d'utiliser une source extérieure de courant électrique pour maîtriser le courant corrosif et empêcher la corrosion. Essentiellement, ce processus (appelé courant imposé) confère une charge électrique négative continue au métal à protéger.Cette charge surpasse le courant, provoquant la sortie des électrons du métal, stoppant la corrosion. Ce type de protection est souvent utilisé pour les structures métalliques enterrées telles que les réservoirs de stockage et les pipelines.
3 Utilisez un courant imposé. Parce que le processus chimique à l'origine de la corrosion des métaux implique un courant électrique sous la forme d'électrons sortant du métal, il est possible d'utiliser une source extérieure de courant électrique pour maîtriser le courant corrosif et empêcher la corrosion. Essentiellement, ce processus (appelé courant imposé) confère une charge électrique négative continue au métal à protéger.Cette charge surpasse le courant, provoquant la sortie des électrons du métal, stoppant la corrosion. Ce type de protection est souvent utilisé pour les structures métalliques enterrées telles que les réservoirs de stockage et les pipelines.  4 Utilisez l'anodisation. L'anodisation est un type spécial de revêtement de surface protecteur utilisé pour protéger le métal de la corrosion et également pour appliquer des matrices, etc. Si vous avez déjà vu un mousqueton en métal de couleur vive, vous avez vu une surface métallique anodisée teinte. Plutôt que d’appliquer l’application physique d’un revêtement protecteur, comme dans le cas de la peinture, l’anodisation utilise un courant électrique pour donner au métal un revêtement protecteur qui prévient presque toutes les formes de corrosion.
4 Utilisez l'anodisation. L'anodisation est un type spécial de revêtement de surface protecteur utilisé pour protéger le métal de la corrosion et également pour appliquer des matrices, etc. Si vous avez déjà vu un mousqueton en métal de couleur vive, vous avez vu une surface métallique anodisée teinte. Plutôt que d’appliquer l’application physique d’un revêtement protecteur, comme dans le cas de la peinture, l’anodisation utilise un courant électrique pour donner au métal un revêtement protecteur qui prévient presque toutes les formes de corrosion.  5 Utilisez un métal qui présente une passivation. Comme indiqué ci-dessus, certains métaux forment naturellement un revêtement d'oxyde protecteur lors d'une exposition à l'air. Certains métaux forment ce revêtement d'oxyde si efficacement qu'ils finissent par devenir relativement inactifs chimiquement. Nous disons que ces métaux sont passif en référence au processus de passivation par lequel ils deviennent moins réactifs. Selon son utilisation souhaitée, un objet en métal passif peut ne pas nécessairement avoir besoin toute protection supplémentaire pour le rendre résistant à la corrosion.
5 Utilisez un métal qui présente une passivation. Comme indiqué ci-dessus, certains métaux forment naturellement un revêtement d'oxyde protecteur lors d'une exposition à l'air. Certains métaux forment ce revêtement d'oxyde si efficacement qu'ils finissent par devenir relativement inactifs chimiquement. Nous disons que ces métaux sont passif en référence au processus de passivation par lequel ils deviennent moins réactifs. Selon son utilisation souhaitée, un objet en métal passif peut ne pas nécessairement avoir besoin toute protection supplémentaire pour le rendre résistant à la corrosion.