La coloration de Gram est une procédure rapide utilisée pour rechercher la présence de bactéries dans les échantillons de tissus et pour caractériser les bactéries comme étant Gram-positives ou Gram-négatives, en fonction des propriétés chimiques et physiques de leurs parois cellulaires.[1] La coloration de Gram doit presque toujours être effectuée comme première étape du diagnostic d'une infection bactérienne.
La coloration de Gram porte le nom du scientifique danois Hans Christian Gram (1853-1938), qui a mis au point la technique en 1882 et l'a publiée en 1884 comme technique de distinction entre deux types de bactéries présentant des symptômes cliniques similaires: Streptococcus pneumoniae (également connu sous le pneumocoque) et Klebsiella pneumoniae bactéries.[2]
Première partie de trois:
Préparer une coloration de Gram
-
 1 Préparez-vous au travail de laboratoire. Mettez des gants et attachez les cheveux longs pour éviter de contaminer l'échantillon de bactéries que vous allez tester. Désinfecter un espace de travail sous la hotte ou dans un autre endroit bien ventilé. Vérifiez que le bec Bunsen et le microscope sont fonctionnels avant de commencer.
1 Préparez-vous au travail de laboratoire. Mettez des gants et attachez les cheveux longs pour éviter de contaminer l'échantillon de bactéries que vous allez tester. Désinfecter un espace de travail sous la hotte ou dans un autre endroit bien ventilé. Vérifiez que le bec Bunsen et le microscope sont fonctionnels avant de commencer. -
 2 Stériliser une lame de microscope en verre. Si la lame de verre est sale, lavez-la dans de l'eau savonneuse pour enlever la graisse et la saleté. Désinfectez la lame avec de l'éthanol, un nettoyant à vitre ou selon la méthode recommandée par votre laboratoire.
2 Stériliser une lame de microscope en verre. Si la lame de verre est sale, lavez-la dans de l'eau savonneuse pour enlever la graisse et la saleté. Désinfectez la lame avec de l'éthanol, un nettoyant à vitre ou selon la méthode recommandée par votre laboratoire. -
 3 Ajoutez l'échantillon à la diapositive. Vous pouvez utiliser la méthode de coloration de Gram pour identifier les bactéries présentes dans les échantillons médicaux ou les cultures bactériennes cultivées dans une boîte de Pétri. Pour que la coloration de Gram soit utile, ajoutez un mince couche de l'échantillon sur la tache. Un échantillon de moins de 24 heures est recommandé, car les bactéries plus anciennes peuvent avoir des parois cellulaires endommagées qui réagissent de manière moins prévisible à la coloration des grammes.[3]
3 Ajoutez l'échantillon à la diapositive. Vous pouvez utiliser la méthode de coloration de Gram pour identifier les bactéries présentes dans les échantillons médicaux ou les cultures bactériennes cultivées dans une boîte de Pétri. Pour que la coloration de Gram soit utile, ajoutez un mince couche de l'échantillon sur la tache. Un échantillon de moins de 24 heures est recommandé, car les bactéries plus anciennes peuvent avoir des parois cellulaires endommagées qui réagissent de manière moins prévisible à la coloration des grammes.[3] - Si vous utilisez un échantillon de tissu, ajoutez 1-2 gouttes sur la lame de verre. Étalez-le uniformément sur la lame pour former un mince frottis, en utilisant le bord d'une deuxième lame de verre stérilisée. Laisser sécher à l'air avant de continuer.
- Si vous prenez des bactéries dans une boîte de Pétri, stérilisez une boucle d'inoculation dans une flamme de bec Bunsen jusqu'à ce qu'elle soit allumée, puis laissez-la refroidir. Utilisez-le pour déposer une goutte d'eau stérile sur la lame, puis stérilisez et refroidissez à nouveau la boucle avant de transférer un petit échantillon de bactéries et de remuer doucement dans l'eau.[4]
- Les bactéries dans le bouillon doivent être mélangées dans un vortex, puis ajoutées avec une boucle d'inoculation comme ci-dessus, sans ajouter d'eau supplémentaire.[5]
- Si vous avez un échantillon de coton-tige, faites rouler légèrement le coton sur la lame.[6]
-
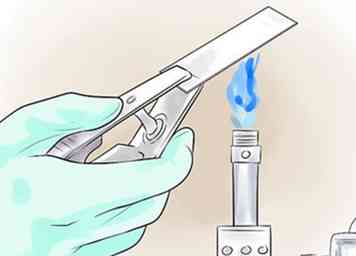 4 La chaleur fixe le frottis. La chaleur va fixer les bactéries sur la lame, elles ne sont donc pas aussi facilement rincées pendant la coloration. Passez rapidement la lame deux ou trois fois à travers une flamme du bec Bunsen ou faites-la chauffer sur un chauffe-plat électrique. Ne pas surchauffer ou les échantillons peuvent être déformés. Si vous utilisez un bec Bunsen, la flamme devrait être un petit cône bleu et non un grand orange.[7]
4 La chaleur fixe le frottis. La chaleur va fixer les bactéries sur la lame, elles ne sont donc pas aussi facilement rincées pendant la coloration. Passez rapidement la lame deux ou trois fois à travers une flamme du bec Bunsen ou faites-la chauffer sur un chauffe-plat électrique. Ne pas surchauffer ou les échantillons peuvent être déformés. Si vous utilisez un bec Bunsen, la flamme devrait être un petit cône bleu et non un grand orange.[7] - Alternativement, le frottis peut être fixé à la place du méthanol, en ajoutant 1-2 gouttes de méthanol sur le frottis séché, en évacuant l'excès de méthanol et en le laissant sécher à l'air. Cette méthode minimise les dommages aux cellules hôtes, donnant un arrière-plan plus propre.
-
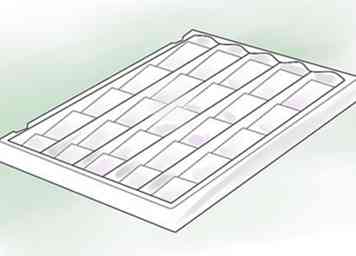 5 Placez la diapositive sur un plateau de coloration. Un plateau de coloration est un plat peu profond en métal, en verre ou en plastique avec un petit support en treillis ou en fil métallique. Placez la diapositive sur ce support, de sorte que les liquides que vous utiliserez puissent s’écouler dans le bac.
5 Placez la diapositive sur un plateau de coloration. Un plateau de coloration est un plat peu profond en métal, en verre ou en plastique avec un petit support en treillis ou en fil métallique. Placez la diapositive sur ce support, de sorte que les liquides que vous utiliserez puissent s’écouler dans le bac. - Si vous ne disposez pas d'un bac de coloration, la lame peut être placée directement sur un bac à glaçons en plastique.[8]
Deuxième partie de trois:
Effectuer la coloration de Gram
-
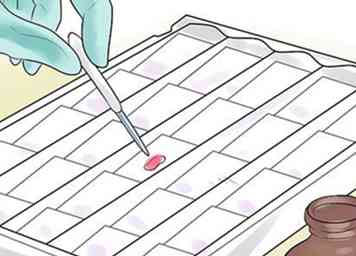 1 Inonder le frottis de cristal violet. Utilisez une pipette pour inonder l'échantillon de bactéries de plusieurs gouttes de colorant cristal violet, parfois appelé violet de gentiane. Attendez trente à soixante secondes. Le cristal violet (CV) se dissocie dans les solutions aqueuses en ions CV + et chlorure (Cl-). Ces ions pénètrent à travers la paroi cellulaire et la membrane cellulaire des cellules à gram positif et à gram négatif. L'ion CV + interagit avec les composants chargés négativement des cellules bactériennes pour colorer les cellules en violet.
1 Inonder le frottis de cristal violet. Utilisez une pipette pour inonder l'échantillon de bactéries de plusieurs gouttes de colorant cristal violet, parfois appelé violet de gentiane. Attendez trente à soixante secondes. Le cristal violet (CV) se dissocie dans les solutions aqueuses en ions CV + et chlorure (Cl-). Ces ions pénètrent à travers la paroi cellulaire et la membrane cellulaire des cellules à gram positif et à gram négatif. L'ion CV + interagit avec les composants chargés négativement des cellules bactériennes pour colorer les cellules en violet. - De nombreux laboratoires utilisent le cristal violet "Hucker's", qui ajoute de l'oxalate d'ammonium pour empêcher la précipitation.[9]
-
 2 Rincez doucement le cristal violet. Inclinez la lame et utilisez une bouteille de lavage pour aspirer un petit jet d'eau distillée ou d'eau du robinet sur le dessus de la lame. L'eau doit couler à la surface du frottis, mais ne doit pas être dirigée directement dessus.[10] Ne pas rincer excessivement, ce qui pourrait enlever la tache des bactéries à Gram positif.
2 Rincez doucement le cristal violet. Inclinez la lame et utilisez une bouteille de lavage pour aspirer un petit jet d'eau distillée ou d'eau du robinet sur le dessus de la lame. L'eau doit couler à la surface du frottis, mais ne doit pas être dirigée directement dessus.[10] Ne pas rincer excessivement, ce qui pourrait enlever la tache des bactéries à Gram positif. -
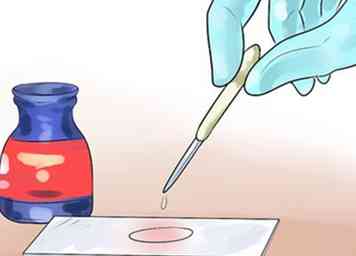 3 Inonder le frottis avec de l'iode, puis rincer. Utilisez une pipette pour couvrir le frottis avec de l'iode. Laisser reposer pendant au moins 60 secondes, puis rincer avec la même méthode prudente.[11] L'iode, sous la forme d'ions chargés négativement, interagit avec CV + pour former de grands complexes de cristal violet et d'iode (complexes CV-I) dans les couches internes et externes de la cellule. Cela va piéger la couleur violet violet du cristal dans la cellule, où qu’elle soit colorée.
3 Inonder le frottis avec de l'iode, puis rincer. Utilisez une pipette pour couvrir le frottis avec de l'iode. Laisser reposer pendant au moins 60 secondes, puis rincer avec la même méthode prudente.[11] L'iode, sous la forme d'ions chargés négativement, interagit avec CV + pour former de grands complexes de cristal violet et d'iode (complexes CV-I) dans les couches internes et externes de la cellule. Cela va piéger la couleur violet violet du cristal dans la cellule, où qu’elle soit colorée. - L'iode est corrosif. Éviter l'inhalation, l'ingestion ou le contact avec la peau.
-
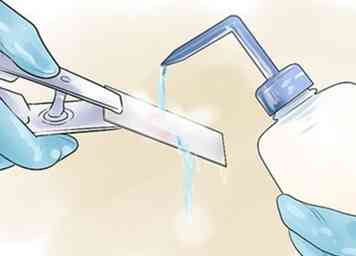 4 Ajouter un décolorant, puis rincer rapidement. Un mélange à 1: 1 d'acétone et d'éthanol est généralement utilisé pour cette étape critique, qui doit être soigneusement chronométrée. Tenez la diapositive en angle, puis ajoutez le décolorant jusqu'à ce que la couleur violette ne soit plus visible dans le ruissellement drainant. Cela prend généralement moins de 10 secondes, voire moins si le décolorant contient des concentrations d'acétone plus élevées. Arrêtez immédiatement, ou le décolorant enlèvera la tache de cristal violet des cellules gram positives et négatives, et la tache devra être répétée. Rincez immédiatement l'excès de décolorant en utilisant la technique antérieure.
4 Ajouter un décolorant, puis rincer rapidement. Un mélange à 1: 1 d'acétone et d'éthanol est généralement utilisé pour cette étape critique, qui doit être soigneusement chronométrée. Tenez la diapositive en angle, puis ajoutez le décolorant jusqu'à ce que la couleur violette ne soit plus visible dans le ruissellement drainant. Cela prend généralement moins de 10 secondes, voire moins si le décolorant contient des concentrations d'acétone plus élevées. Arrêtez immédiatement, ou le décolorant enlèvera la tache de cristal violet des cellules gram positives et négatives, et la tache devra être répétée. Rincez immédiatement l'excès de décolorant en utilisant la technique antérieure. - De l'acétone pure (95% +) peut être utilisée à la place.[12] Plus il y a d'acétone, plus le décolorant fonctionnera rapidement, nécessitant un timing plus précis.
- Si vous ne parvenez pas à synchroniser cette étape, envisagez d'ajouter le décoloreur goutte à goutte.[13]
-
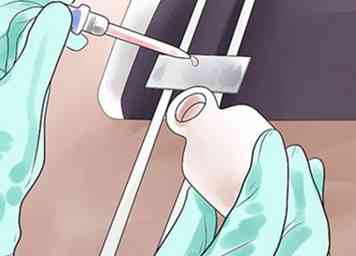 5 Inonder le frottis avec du bois, puis rincer. Un contre-colorant, généralement de la safranine ou de la fuchsine, est utilisé pour ajouter un contraste supplémentaire entre les bactéries à Gram négatif et les bactéries à Gram positif, en colorant les bactéries décolorées (gram négatif), roses ou rouges.[14][15] Laissez-le pendant au moins 45 secondes, puis rincez.[16]
5 Inonder le frottis avec du bois, puis rincer. Un contre-colorant, généralement de la safranine ou de la fuchsine, est utilisé pour ajouter un contraste supplémentaire entre les bactéries à Gram négatif et les bactéries à Gram positif, en colorant les bactéries décolorées (gram négatif), roses ou rouges.[14][15] Laissez-le pendant au moins 45 secondes, puis rincez.[16] - La fuchsine colorera plus intensément de nombreuses bactéries Gram-négatives, telles que haemophilus spp et legionella spp.[17] Cela peut en faire une meilleure option pour les débutants.
-
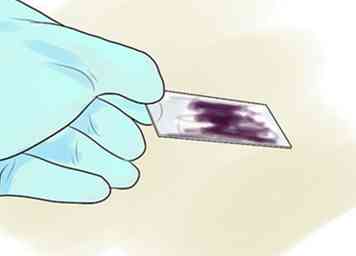 6 Séchez la lame. Vous pouvez laisser la lame sécher à l'air ou l'éponger avec du papier absorbant vendu à cette fin.[18] La coloration de Gram est complète.
6 Séchez la lame. Vous pouvez laisser la lame sécher à l'air ou l'éponger avec du papier absorbant vendu à cette fin.[18] La coloration de Gram est complète.
Troisième partie de trois:
Examen du résultat
-
 1 Préparez le microscope optique. Placez la lame sous le microscope optique. La taille des bactéries varie beaucoup, de sorte que le grossissement total requis variera de 400x à 1000x.[19] À l'extrémité supérieure de ces agrandissements, un objectif à immersion dans l'huile est recommandé pour plus de clarté. Placer une goutte d'huile d'immersion sur la lame, en évitant tout mouvement pendant l'application pour éviter les bulles.[20] Déplacez la tourelle du microscope de manière à ce que la lentille de l’objectif se mette en place en touchant l’huile.
1 Préparez le microscope optique. Placez la lame sous le microscope optique. La taille des bactéries varie beaucoup, de sorte que le grossissement total requis variera de 400x à 1000x.[19] À l'extrémité supérieure de ces agrandissements, un objectif à immersion dans l'huile est recommandé pour plus de clarté. Placer une goutte d'huile d'immersion sur la lame, en évitant tout mouvement pendant l'application pour éviter les bulles.[20] Déplacez la tourelle du microscope de manière à ce que la lentille de l’objectif se mette en place en touchant l’huile. - L’immersion dans l’huile ne peut être utilisée que sur des lentilles spécialement conçues, et non sur des lentilles «sèches».
-
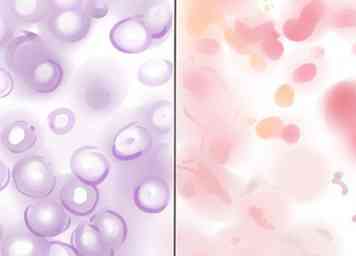 2 Identifier les bactéries à Gram positif et à Gram négatif. Examiner la lame sous le microscope optique. Les bactéries à Gram positif apparaissent en violet, en raison du cristal violet piégé dans leurs parois cellulaires épaisses. Les bactéries Gram-négatives apparaissent roses ou rouges, puisque le violet a traversé les fines parois cellulaires, puis le contre-colorant rose est entré.
2 Identifier les bactéries à Gram positif et à Gram négatif. Examiner la lame sous le microscope optique. Les bactéries à Gram positif apparaissent en violet, en raison du cristal violet piégé dans leurs parois cellulaires épaisses. Les bactéries Gram-négatives apparaissent roses ou rouges, puisque le violet a traversé les fines parois cellulaires, puis le contre-colorant rose est entré. - Si l'échantillon est trop épais, vous risquez d'obtenir des résultats faussement positifs. Colorez un nouvel échantillon si tous les types de bactéries sont gram-positifs, pour vous assurer que le résultat est correct.
- Si le décoloreur a fonctionné trop longtemps, vous pouvez voir des résultats faussement négatifs. Colorez un nouvel échantillon si tous les types de bactéries sont gram-négatifs, pour vérifier vos résultats.
-
 3 Recherchez des images de référence. Si vous n'êtes pas certain de ce qu'est une bactérie, parcourez une collection d'images de référence, triées par forme et par résultat. Vous pouvez trouver des bases de données en ligne dans la base de données nationale sur les agents pathogènes microbiens, les bactéries en photos et de nombreux autres sites. Pour faciliter l'identification, des exemples communs ou importants du point de vue diagnostique sont triés ci-dessous par statut et forme.
3 Recherchez des images de référence. Si vous n'êtes pas certain de ce qu'est une bactérie, parcourez une collection d'images de référence, triées par forme et par résultat. Vous pouvez trouver des bases de données en ligne dans la base de données nationale sur les agents pathogènes microbiens, les bactéries en photos et de nombreux autres sites. Pour faciliter l'identification, des exemples communs ou importants du point de vue diagnostique sont triés ci-dessous par statut et forme. -
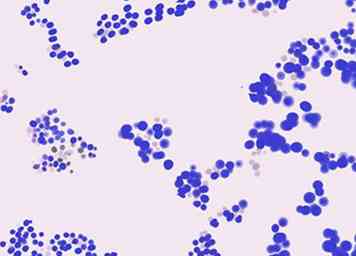 4 Identifier les bactéries Gram-positives par leur forme. Les bactéries sont en outre classées selon leur forme au microscope, le plus souvent sous forme de cocci (sphériques) ou de tiges (cylindriques). Voici quelques bactéries courantes à Gram positif (colorées en violet) organisées par forme:
4 Identifier les bactéries Gram-positives par leur forme. Les bactéries sont en outre classées selon leur forme au microscope, le plus souvent sous forme de cocci (sphériques) ou de tiges (cylindriques). Voici quelques bactéries courantes à Gram positif (colorées en violet) organisées par forme: - Cocci à Gram positif sont généralement soit Staphylocoques (ce qui signifie cocci en grappes) ou Streptocoques (ce qui signifie cocci dans les chaînes).
- Tiges Gram-positives comprendre Bacille, Clostridium, Corynebacterium, et Listeria. Actinomyces spp. les tiges ont souvent des branches ou des filaments.[21]
-
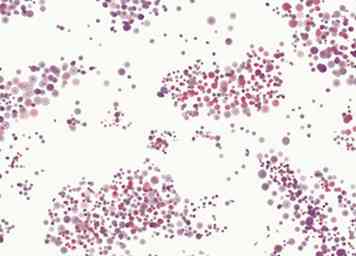 5 Identifier les bactéries à Gram négatif. Les bactéries à Gram négatif (colorées en rose) sont souvent classées en trois groupes. Les cocci sont des bactéries sphériques, les bâtonnets sont longs, les bactéries minces et les tiges coccoïdes se situent quelque part entre les deux.
5 Identifier les bactéries à Gram négatif. Les bactéries à Gram négatif (colorées en rose) sont souvent classées en trois groupes. Les cocci sont des bactéries sphériques, les bâtonnets sont longs, les bactéries minces et les tiges coccoïdes se situent quelque part entre les deux. - Cocci à Gram négatif sont le plus souvent Neisseria spp.
- Barres Gram-négatives comprendre E. coli, Enterobacter, Klebsiella, Citrobacter, Serratia, Proteus, Salmonella, Shigella, Pseudomonas, et plein d'autres. Vibrio cholerae peut apparaître comme des tiges ordinaires ou des tiges courbées.[22]
- Barres "coccoïdes" à Gram négatif (ou "coccobacilles") comprendre Bordetella, Brucella, Haemophilus, et Pasteurella.
-
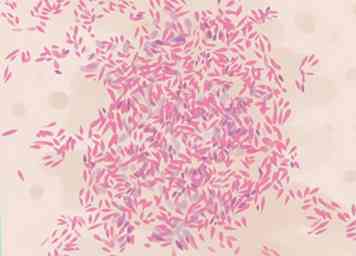 6 Évaluer les résultats mitigés. Certaines bactéries sont difficiles à colorer avec précision en raison de la fragilité ou du caractère cireux de leurs parois cellulaires. Ils peuvent avoir un mélange de taches violettes ou roses dans la même cellule, ou entre différentes cellules dans le même frottis. Tout échantillon de bactérie âgé de plus de 24 heures peut avoir ce problème, mais certaines espèces sont difficiles à colorer à tout âge. Ils peuvent nécessiter des tests plus spécialisés pour affiner l'identification, tels qu'une coloration acido-résistante, une observation de la croissance de la culture, des cultures TSI moyennes ou des tests génétiques.[23]
6 Évaluer les résultats mitigés. Certaines bactéries sont difficiles à colorer avec précision en raison de la fragilité ou du caractère cireux de leurs parois cellulaires. Ils peuvent avoir un mélange de taches violettes ou roses dans la même cellule, ou entre différentes cellules dans le même frottis. Tout échantillon de bactérie âgé de plus de 24 heures peut avoir ce problème, mais certaines espèces sont difficiles à colorer à tout âge. Ils peuvent nécessiter des tests plus spécialisés pour affiner l'identification, tels qu'une coloration acido-résistante, une observation de la croissance de la culture, des cultures TSI moyennes ou des tests génétiques.[23] - Actinomyces, Arthobacter, Corynebacterium, Mycobacterium, et Propionibacterium spp. sont toutes considérées comme des bactéries à Gram positif, mais apparaissent souvent colorées de manière non concluante.[24]
- Bactéries petites et fines telles que Treponema, Chlamydia, et Rickettsia spp. sont difficiles à colorer correctement.[25]
-
 7 Jeter les matériaux. Les procédures d'élimination des déchets varient selon les laboratoires et selon les matériaux utilisés. En règle générale, le liquide dans le bac de coloration est jeté dans des bouteilles scellées en tant que déchets dangereux. Faites tremper les lames dans une solution d'eau de Javel à 10%, puis jetez-les dans des contenants pour objets tranchants.
7 Jeter les matériaux. Les procédures d'élimination des déchets varient selon les laboratoires et selon les matériaux utilisés. En règle générale, le liquide dans le bac de coloration est jeté dans des bouteilles scellées en tant que déchets dangereux. Faites tremper les lames dans une solution d'eau de Javel à 10%, puis jetez-les dans des contenants pour objets tranchants.
 Minotauromaquia
Minotauromaquia
 1 Préparez-vous au travail de laboratoire. Mettez des gants et attachez les cheveux longs pour éviter de contaminer l'échantillon de bactéries que vous allez tester. Désinfecter un espace de travail sous la hotte ou dans un autre endroit bien ventilé. Vérifiez que le bec Bunsen et le microscope sont fonctionnels avant de commencer.
1 Préparez-vous au travail de laboratoire. Mettez des gants et attachez les cheveux longs pour éviter de contaminer l'échantillon de bactéries que vous allez tester. Désinfecter un espace de travail sous la hotte ou dans un autre endroit bien ventilé. Vérifiez que le bec Bunsen et le microscope sont fonctionnels avant de commencer.  2 Stériliser une lame de microscope en verre. Si la lame de verre est sale, lavez-la dans de l'eau savonneuse pour enlever la graisse et la saleté. Désinfectez la lame avec de l'éthanol, un nettoyant à vitre ou selon la méthode recommandée par votre laboratoire.
2 Stériliser une lame de microscope en verre. Si la lame de verre est sale, lavez-la dans de l'eau savonneuse pour enlever la graisse et la saleté. Désinfectez la lame avec de l'éthanol, un nettoyant à vitre ou selon la méthode recommandée par votre laboratoire.  3 Ajoutez l'échantillon à la diapositive. Vous pouvez utiliser la méthode de coloration de Gram pour identifier les bactéries présentes dans les échantillons médicaux ou les cultures bactériennes cultivées dans une boîte de Pétri. Pour que la coloration de Gram soit utile, ajoutez un mince couche de l'échantillon sur la tache. Un échantillon de moins de 24 heures est recommandé, car les bactéries plus anciennes peuvent avoir des parois cellulaires endommagées qui réagissent de manière moins prévisible à la coloration des grammes.[3]
3 Ajoutez l'échantillon à la diapositive. Vous pouvez utiliser la méthode de coloration de Gram pour identifier les bactéries présentes dans les échantillons médicaux ou les cultures bactériennes cultivées dans une boîte de Pétri. Pour que la coloration de Gram soit utile, ajoutez un mince couche de l'échantillon sur la tache. Un échantillon de moins de 24 heures est recommandé, car les bactéries plus anciennes peuvent avoir des parois cellulaires endommagées qui réagissent de manière moins prévisible à la coloration des grammes.[3]  4 La chaleur fixe le frottis. La chaleur va fixer les bactéries sur la lame, elles ne sont donc pas aussi facilement rincées pendant la coloration. Passez rapidement la lame deux ou trois fois à travers une flamme du bec Bunsen ou faites-la chauffer sur un chauffe-plat électrique. Ne pas surchauffer ou les échantillons peuvent être déformés. Si vous utilisez un bec Bunsen, la flamme devrait être un petit cône bleu et non un grand orange.[7]
4 La chaleur fixe le frottis. La chaleur va fixer les bactéries sur la lame, elles ne sont donc pas aussi facilement rincées pendant la coloration. Passez rapidement la lame deux ou trois fois à travers une flamme du bec Bunsen ou faites-la chauffer sur un chauffe-plat électrique. Ne pas surchauffer ou les échantillons peuvent être déformés. Si vous utilisez un bec Bunsen, la flamme devrait être un petit cône bleu et non un grand orange.[7]  5 Placez la diapositive sur un plateau de coloration. Un plateau de coloration est un plat peu profond en métal, en verre ou en plastique avec un petit support en treillis ou en fil métallique. Placez la diapositive sur ce support, de sorte que les liquides que vous utiliserez puissent s’écouler dans le bac.
5 Placez la diapositive sur un plateau de coloration. Un plateau de coloration est un plat peu profond en métal, en verre ou en plastique avec un petit support en treillis ou en fil métallique. Placez la diapositive sur ce support, de sorte que les liquides que vous utiliserez puissent s’écouler dans le bac.  1 Inonder le frottis de cristal violet. Utilisez une pipette pour inonder l'échantillon de bactéries de plusieurs gouttes de colorant cristal violet, parfois appelé violet de gentiane. Attendez trente à soixante secondes. Le cristal violet (CV) se dissocie dans les solutions aqueuses en ions CV + et chlorure (Cl-). Ces ions pénètrent à travers la paroi cellulaire et la membrane cellulaire des cellules à gram positif et à gram négatif. L'ion CV + interagit avec les composants chargés négativement des cellules bactériennes pour colorer les cellules en violet.
1 Inonder le frottis de cristal violet. Utilisez une pipette pour inonder l'échantillon de bactéries de plusieurs gouttes de colorant cristal violet, parfois appelé violet de gentiane. Attendez trente à soixante secondes. Le cristal violet (CV) se dissocie dans les solutions aqueuses en ions CV + et chlorure (Cl-). Ces ions pénètrent à travers la paroi cellulaire et la membrane cellulaire des cellules à gram positif et à gram négatif. L'ion CV + interagit avec les composants chargés négativement des cellules bactériennes pour colorer les cellules en violet.  2 Rincez doucement le cristal violet. Inclinez la lame et utilisez une bouteille de lavage pour aspirer un petit jet d'eau distillée ou d'eau du robinet sur le dessus de la lame. L'eau doit couler à la surface du frottis, mais ne doit pas être dirigée directement dessus.[10] Ne pas rincer excessivement, ce qui pourrait enlever la tache des bactéries à Gram positif.
2 Rincez doucement le cristal violet. Inclinez la lame et utilisez une bouteille de lavage pour aspirer un petit jet d'eau distillée ou d'eau du robinet sur le dessus de la lame. L'eau doit couler à la surface du frottis, mais ne doit pas être dirigée directement dessus.[10] Ne pas rincer excessivement, ce qui pourrait enlever la tache des bactéries à Gram positif.  3 Inonder le frottis avec de l'iode, puis rincer. Utilisez une pipette pour couvrir le frottis avec de l'iode. Laisser reposer pendant au moins 60 secondes, puis rincer avec la même méthode prudente.[11] L'iode, sous la forme d'ions chargés négativement, interagit avec CV + pour former de grands complexes de cristal violet et d'iode (complexes CV-I) dans les couches internes et externes de la cellule. Cela va piéger la couleur violet violet du cristal dans la cellule, où qu’elle soit colorée.
3 Inonder le frottis avec de l'iode, puis rincer. Utilisez une pipette pour couvrir le frottis avec de l'iode. Laisser reposer pendant au moins 60 secondes, puis rincer avec la même méthode prudente.[11] L'iode, sous la forme d'ions chargés négativement, interagit avec CV + pour former de grands complexes de cristal violet et d'iode (complexes CV-I) dans les couches internes et externes de la cellule. Cela va piéger la couleur violet violet du cristal dans la cellule, où qu’elle soit colorée.  4 Ajouter un décolorant, puis rincer rapidement. Un mélange à 1: 1 d'acétone et d'éthanol est généralement utilisé pour cette étape critique, qui doit être soigneusement chronométrée. Tenez la diapositive en angle, puis ajoutez le décolorant jusqu'à ce que la couleur violette ne soit plus visible dans le ruissellement drainant. Cela prend généralement moins de 10 secondes, voire moins si le décolorant contient des concentrations d'acétone plus élevées. Arrêtez immédiatement, ou le décolorant enlèvera la tache de cristal violet des cellules gram positives et négatives, et la tache devra être répétée. Rincez immédiatement l'excès de décolorant en utilisant la technique antérieure.
4 Ajouter un décolorant, puis rincer rapidement. Un mélange à 1: 1 d'acétone et d'éthanol est généralement utilisé pour cette étape critique, qui doit être soigneusement chronométrée. Tenez la diapositive en angle, puis ajoutez le décolorant jusqu'à ce que la couleur violette ne soit plus visible dans le ruissellement drainant. Cela prend généralement moins de 10 secondes, voire moins si le décolorant contient des concentrations d'acétone plus élevées. Arrêtez immédiatement, ou le décolorant enlèvera la tache de cristal violet des cellules gram positives et négatives, et la tache devra être répétée. Rincez immédiatement l'excès de décolorant en utilisant la technique antérieure.  5 Inonder le frottis avec du bois, puis rincer. Un contre-colorant, généralement de la safranine ou de la fuchsine, est utilisé pour ajouter un contraste supplémentaire entre les bactéries à Gram négatif et les bactéries à Gram positif, en colorant les bactéries décolorées (gram négatif), roses ou rouges.[14][15] Laissez-le pendant au moins 45 secondes, puis rincez.[16]
5 Inonder le frottis avec du bois, puis rincer. Un contre-colorant, généralement de la safranine ou de la fuchsine, est utilisé pour ajouter un contraste supplémentaire entre les bactéries à Gram négatif et les bactéries à Gram positif, en colorant les bactéries décolorées (gram négatif), roses ou rouges.[14][15] Laissez-le pendant au moins 45 secondes, puis rincez.[16]  6 Séchez la lame. Vous pouvez laisser la lame sécher à l'air ou l'éponger avec du papier absorbant vendu à cette fin.[18] La coloration de Gram est complète.
6 Séchez la lame. Vous pouvez laisser la lame sécher à l'air ou l'éponger avec du papier absorbant vendu à cette fin.[18] La coloration de Gram est complète.  1 Préparez le microscope optique. Placez la lame sous le microscope optique. La taille des bactéries varie beaucoup, de sorte que le grossissement total requis variera de 400x à 1000x.[19] À l'extrémité supérieure de ces agrandissements, un objectif à immersion dans l'huile est recommandé pour plus de clarté. Placer une goutte d'huile d'immersion sur la lame, en évitant tout mouvement pendant l'application pour éviter les bulles.[20] Déplacez la tourelle du microscope de manière à ce que la lentille de l’objectif se mette en place en touchant l’huile.
1 Préparez le microscope optique. Placez la lame sous le microscope optique. La taille des bactéries varie beaucoup, de sorte que le grossissement total requis variera de 400x à 1000x.[19] À l'extrémité supérieure de ces agrandissements, un objectif à immersion dans l'huile est recommandé pour plus de clarté. Placer une goutte d'huile d'immersion sur la lame, en évitant tout mouvement pendant l'application pour éviter les bulles.[20] Déplacez la tourelle du microscope de manière à ce que la lentille de l’objectif se mette en place en touchant l’huile.  2 Identifier les bactéries à Gram positif et à Gram négatif. Examiner la lame sous le microscope optique. Les bactéries à Gram positif apparaissent en violet, en raison du cristal violet piégé dans leurs parois cellulaires épaisses. Les bactéries Gram-négatives apparaissent roses ou rouges, puisque le violet a traversé les fines parois cellulaires, puis le contre-colorant rose est entré.
2 Identifier les bactéries à Gram positif et à Gram négatif. Examiner la lame sous le microscope optique. Les bactéries à Gram positif apparaissent en violet, en raison du cristal violet piégé dans leurs parois cellulaires épaisses. Les bactéries Gram-négatives apparaissent roses ou rouges, puisque le violet a traversé les fines parois cellulaires, puis le contre-colorant rose est entré.  3 Recherchez des images de référence. Si vous n'êtes pas certain de ce qu'est une bactérie, parcourez une collection d'images de référence, triées par forme et par résultat. Vous pouvez trouver des bases de données en ligne dans la base de données nationale sur les agents pathogènes microbiens, les bactéries en photos et de nombreux autres sites. Pour faciliter l'identification, des exemples communs ou importants du point de vue diagnostique sont triés ci-dessous par statut et forme.
3 Recherchez des images de référence. Si vous n'êtes pas certain de ce qu'est une bactérie, parcourez une collection d'images de référence, triées par forme et par résultat. Vous pouvez trouver des bases de données en ligne dans la base de données nationale sur les agents pathogènes microbiens, les bactéries en photos et de nombreux autres sites. Pour faciliter l'identification, des exemples communs ou importants du point de vue diagnostique sont triés ci-dessous par statut et forme.  4 Identifier les bactéries Gram-positives par leur forme. Les bactéries sont en outre classées selon leur forme au microscope, le plus souvent sous forme de cocci (sphériques) ou de tiges (cylindriques). Voici quelques bactéries courantes à Gram positif (colorées en violet) organisées par forme:
4 Identifier les bactéries Gram-positives par leur forme. Les bactéries sont en outre classées selon leur forme au microscope, le plus souvent sous forme de cocci (sphériques) ou de tiges (cylindriques). Voici quelques bactéries courantes à Gram positif (colorées en violet) organisées par forme:  5 Identifier les bactéries à Gram négatif. Les bactéries à Gram négatif (colorées en rose) sont souvent classées en trois groupes. Les cocci sont des bactéries sphériques, les bâtonnets sont longs, les bactéries minces et les tiges coccoïdes se situent quelque part entre les deux.
5 Identifier les bactéries à Gram négatif. Les bactéries à Gram négatif (colorées en rose) sont souvent classées en trois groupes. Les cocci sont des bactéries sphériques, les bâtonnets sont longs, les bactéries minces et les tiges coccoïdes se situent quelque part entre les deux.  6 Évaluer les résultats mitigés. Certaines bactéries sont difficiles à colorer avec précision en raison de la fragilité ou du caractère cireux de leurs parois cellulaires. Ils peuvent avoir un mélange de taches violettes ou roses dans la même cellule, ou entre différentes cellules dans le même frottis. Tout échantillon de bactérie âgé de plus de 24 heures peut avoir ce problème, mais certaines espèces sont difficiles à colorer à tout âge. Ils peuvent nécessiter des tests plus spécialisés pour affiner l'identification, tels qu'une coloration acido-résistante, une observation de la croissance de la culture, des cultures TSI moyennes ou des tests génétiques.[23]
6 Évaluer les résultats mitigés. Certaines bactéries sont difficiles à colorer avec précision en raison de la fragilité ou du caractère cireux de leurs parois cellulaires. Ils peuvent avoir un mélange de taches violettes ou roses dans la même cellule, ou entre différentes cellules dans le même frottis. Tout échantillon de bactérie âgé de plus de 24 heures peut avoir ce problème, mais certaines espèces sont difficiles à colorer à tout âge. Ils peuvent nécessiter des tests plus spécialisés pour affiner l'identification, tels qu'une coloration acido-résistante, une observation de la croissance de la culture, des cultures TSI moyennes ou des tests génétiques.[23]  7 Jeter les matériaux. Les procédures d'élimination des déchets varient selon les laboratoires et selon les matériaux utilisés. En règle générale, le liquide dans le bac de coloration est jeté dans des bouteilles scellées en tant que déchets dangereux. Faites tremper les lames dans une solution d'eau de Javel à 10%, puis jetez-les dans des contenants pour objets tranchants.
7 Jeter les matériaux. Les procédures d'élimination des déchets varient selon les laboratoires et selon les matériaux utilisés. En règle générale, le liquide dans le bac de coloration est jeté dans des bouteilles scellées en tant que déchets dangereux. Faites tremper les lames dans une solution d'eau de Javel à 10%, puis jetez-les dans des contenants pour objets tranchants.