Lorsque quelque chose brûle, il libère de l'énergie sous forme de chaleur et de lumière. La quantité d'énergie libérée par une flamme particulière diffère en fonction du combustible brûlé. Vous pouvez tester la quantité d'énergie libérée par un carburant en mesurant le changement de température que la flamme crée dans un récipient d'eau. L'un des moyens de mesurer l'énergie consiste à construire un calorimètre, qui mesure la quantité de chaleur impliquée dans une réaction chimique ou un processus thermique.
Première partie de trois:
Construire un calorimètre simple
-
 1 Mesurer l'eau avec un cylindre gradué. Il est important de savoir exactement combien d’eau vous utilisez. Cela vous permettra de calculer la quantité d'énergie utilisée pour chauffer l'eau. Utilisez un cylindre gradué pour mesurer avec précision 100 millilitres (3,4 oz liq) d'eau pour l'expérience. Notez ce montant dans un cahier.[1]
1 Mesurer l'eau avec un cylindre gradué. Il est important de savoir exactement combien d’eau vous utilisez. Cela vous permettra de calculer la quantité d'énergie utilisée pour chauffer l'eau. Utilisez un cylindre gradué pour mesurer avec précision 100 millilitres (3,4 oz liq) d'eau pour l'expérience. Notez ce montant dans un cahier.[1] -
 2 Versez l'eau dans une canette de soda. Une canette de soda en aluminium conduira la chaleur plus efficacement qu'un cylindre en verre. Veillez à ne pas renverser l'eau. Il est important que la quantité d’eau que vous avez enregistrée soit correcte.[2]
2 Versez l'eau dans une canette de soda. Une canette de soda en aluminium conduira la chaleur plus efficacement qu'un cylindre en verre. Veillez à ne pas renverser l'eau. Il est important que la quantité d’eau que vous avez enregistrée soit correcte.[2] -
 3 Placez la canette sur votre source de carburant. Comme la chaleur augmente, vous obtiendrez le maximum de transfert de chaleur si la boîte est placée directement sur la source de carburant. Utilisez un support ou construisez un appareil simple de quelque sorte pour tenir la boîte de 6 à 8 centimètres au-dessus de la source de carburant. Utilisez du métal pour maintenir la boîte en place.[3]
3 Placez la canette sur votre source de carburant. Comme la chaleur augmente, vous obtiendrez le maximum de transfert de chaleur si la boîte est placée directement sur la source de carburant. Utilisez un support ou construisez un appareil simple de quelque sorte pour tenir la boîte de 6 à 8 centimètres au-dessus de la source de carburant. Utilisez du métal pour maintenir la boîte en place.[3] - Des matériaux comme le bois ou le plastique peuvent fondre ou prendre feu, veillez donc à utiliser des matériaux résistants au feu pour construire le stand.
Deuxième partie de trois:
Mesurer les changements de température
-
 1 Mesurer la température initiale de l'eau. Sans la température initiale de l'eau, vous ne pourrez pas savoir combien de chaleur a été absorbée. Mettez un thermomètre dans l'eau et faites une lecture. Notez la lecture pour que vous vous en souveniez exactement.
1 Mesurer la température initiale de l'eau. Sans la température initiale de l'eau, vous ne pourrez pas savoir combien de chaleur a été absorbée. Mettez un thermomètre dans l'eau et faites une lecture. Notez la lecture pour que vous vous en souveniez exactement. - Par exemple, votre lecture initiale pourrait être de 20 ° C (68 ° F). Il est préférable de prendre la mesure en degrés Celsius, car cela simplifiera vos calculs plus tard.
-
 2 Allumez le carburant sous l'eau. Utilisez une allumette ou un briquet pour allumer le carburant. Les combustibles courants à tester comprennent l'huile d'arachide, l'huile végétale, le méthanol ou l'éthanol. Cette étape doit être effectuée par ou avec un adulte superviseur.[4]
2 Allumez le carburant sous l'eau. Utilisez une allumette ou un briquet pour allumer le carburant. Les combustibles courants à tester comprennent l'huile d'arachide, l'huile végétale, le méthanol ou l'éthanol. Cette étape doit être effectuée par ou avec un adulte superviseur.[4] - Portez des gants et des lunettes de protection pour protéger vos yeux et vos mains.
- Avant d'allumer le carburant, élaborez un plan de sécurité en cas de problème ou de propagation du feu. Gardez un extincteur à proximité.
-
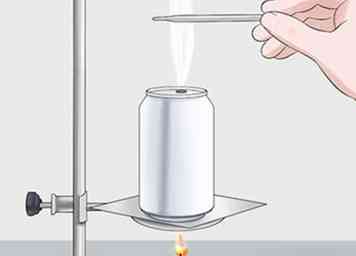 3 Prenez une lecture finale de la température de l'eau. Une fois que tout le carburant a brûlé ou que vous l'avez éteint, vous aurez besoin d'une deuxième lecture de la température. Utilisez le même thermomètre et insérez-le dans l'eau. Enregistrez la température finale à utiliser pour calculer l'énergie libérée par la combustion du carburant.
3 Prenez une lecture finale de la température de l'eau. Une fois que tout le carburant a brûlé ou que vous l'avez éteint, vous aurez besoin d'une deuxième lecture de la température. Utilisez le même thermomètre et insérez-le dans l'eau. Enregistrez la température finale à utiliser pour calculer l'énergie libérée par la combustion du carburant. - Votre lecture finale devrait être supérieure à votre lecture initiale. Par exemple, il peut être autour de 24 ° C (75 ° F), selon votre carburant.
Troisième partie de trois:
Calcul de l'énergie libérée
-
 1 Trouvez la différence de température. Soustraire la température initiale de la température finale. Cela vous dira combien la température de l'eau a été modifiée par le combustible en dessous. Convertissez ce nombre en degrés Celsius si vos mesures ne sont pas en degrés Celsius.
1 Trouvez la différence de température. Soustraire la température initiale de la température finale. Cela vous dira combien la température de l'eau a été modifiée par le combustible en dessous. Convertissez ce nombre en degrés Celsius si vos mesures ne sont pas en degrés Celsius. - Vous pouvez convertir un nombre de Fahrenheit en Celsius en utilisant l'équation où C est la température en degrés Celsius et F la température en degrés Fahrenheit.
- Un exemple est 24 ° C (75,2 ° F) - 20 ° C (68,0 ° F) = 4 ° C (39,2 ° F).
-
 2 Multipliez la différence de température par la chaleur spécifique de l'eau. La chaleur spécifique de l'eau est la quantité de chaleur nécessaire pour élever la température de 1 gramme d'eau de 1 degré Celsius. Pour l'eau, la chaleur spécifique est de 1 calorie par gramme Celsius. Cela signifie qu'il faut 1 calorie pour chauffer 1 gramme d'eau de 1 degré Celsius.[5]
2 Multipliez la différence de température par la chaleur spécifique de l'eau. La chaleur spécifique de l'eau est la quantité de chaleur nécessaire pour élever la température de 1 gramme d'eau de 1 degré Celsius. Pour l'eau, la chaleur spécifique est de 1 calorie par gramme Celsius. Cela signifie qu'il faut 1 calorie pour chauffer 1 gramme d'eau de 1 degré Celsius.[5] - L'unité pour la chaleur spécifique est écrite comme 1 calorie / (gramme x degrés Celsius).
- En multipliant cela par la différence de température, on obtient 4 degrés Celsius x 1 calorie / (gramme x degré Celsius) = 4 calories / gramme.
-
 3 Facteur dans la masse de l'eau. Maintenant, multipliez le produit de la différence de chaleur et de la chaleur spécifique par la quantité d'eau que vous avez utilisée. Notez que 1 ml d'eau équivaut à 1 gramme d'eau. Assurez-vous que vous utilisez les unités grammes.[6]
3 Facteur dans la masse de l'eau. Maintenant, multipliez le produit de la différence de chaleur et de la chaleur spécifique par la quantité d'eau que vous avez utilisée. Notez que 1 ml d'eau équivaut à 1 gramme d'eau. Assurez-vous que vous utilisez les unités grammes.[6] - Cela donnera votre libération énergétique: 4 calories / gramme x 100 grammes = 400 calories.
-
 4 Réalisez que votre système perd de l'énergie. Alors qu'une partie de la chaleur dégagée va directement dans l'eau, votre système n'est pas parfait. De la chaleur sera perdue dans l'air ambiant. Une petite quantité de chaleur sera également absorbée par la boîte elle-même. Il y a peu à faire pour compenser la perte de chaleur.[7]
4 Réalisez que votre système perd de l'énergie. Alors qu'une partie de la chaleur dégagée va directement dans l'eau, votre système n'est pas parfait. De la chaleur sera perdue dans l'air ambiant. Une petite quantité de chaleur sera également absorbée par la boîte elle-même. Il y a peu à faire pour compenser la perte de chaleur.[7] - Si vous essayez de faire des expériences très précises, vous pouvez investir dans un calorimètre commercial, mais même dans ce cas, les résultats peuvent ne pas être efficaces à 100%.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Mesurer l'eau avec un cylindre gradué. Il est important de savoir exactement combien d’eau vous utilisez. Cela vous permettra de calculer la quantité d'énergie utilisée pour chauffer l'eau. Utilisez un cylindre gradué pour mesurer avec précision 100 millilitres (3,4 oz liq) d'eau pour l'expérience. Notez ce montant dans un cahier.[1]
1 Mesurer l'eau avec un cylindre gradué. Il est important de savoir exactement combien d’eau vous utilisez. Cela vous permettra de calculer la quantité d'énergie utilisée pour chauffer l'eau. Utilisez un cylindre gradué pour mesurer avec précision 100 millilitres (3,4 oz liq) d'eau pour l'expérience. Notez ce montant dans un cahier.[1]  2 Versez l'eau dans une canette de soda. Une canette de soda en aluminium conduira la chaleur plus efficacement qu'un cylindre en verre. Veillez à ne pas renverser l'eau. Il est important que la quantité d’eau que vous avez enregistrée soit correcte.[2]
2 Versez l'eau dans une canette de soda. Une canette de soda en aluminium conduira la chaleur plus efficacement qu'un cylindre en verre. Veillez à ne pas renverser l'eau. Il est important que la quantité d’eau que vous avez enregistrée soit correcte.[2]  3 Placez la canette sur votre source de carburant. Comme la chaleur augmente, vous obtiendrez le maximum de transfert de chaleur si la boîte est placée directement sur la source de carburant. Utilisez un support ou construisez un appareil simple de quelque sorte pour tenir la boîte de 6 à 8 centimètres au-dessus de la source de carburant. Utilisez du métal pour maintenir la boîte en place.[3]
3 Placez la canette sur votre source de carburant. Comme la chaleur augmente, vous obtiendrez le maximum de transfert de chaleur si la boîte est placée directement sur la source de carburant. Utilisez un support ou construisez un appareil simple de quelque sorte pour tenir la boîte de 6 à 8 centimètres au-dessus de la source de carburant. Utilisez du métal pour maintenir la boîte en place.[3]  1 Mesurer la température initiale de l'eau. Sans la température initiale de l'eau, vous ne pourrez pas savoir combien de chaleur a été absorbée. Mettez un thermomètre dans l'eau et faites une lecture. Notez la lecture pour que vous vous en souveniez exactement.
1 Mesurer la température initiale de l'eau. Sans la température initiale de l'eau, vous ne pourrez pas savoir combien de chaleur a été absorbée. Mettez un thermomètre dans l'eau et faites une lecture. Notez la lecture pour que vous vous en souveniez exactement.  2 Allumez le carburant sous l'eau. Utilisez une allumette ou un briquet pour allumer le carburant. Les combustibles courants à tester comprennent l'huile d'arachide, l'huile végétale, le méthanol ou l'éthanol. Cette étape doit être effectuée par ou avec un adulte superviseur.[4]
2 Allumez le carburant sous l'eau. Utilisez une allumette ou un briquet pour allumer le carburant. Les combustibles courants à tester comprennent l'huile d'arachide, l'huile végétale, le méthanol ou l'éthanol. Cette étape doit être effectuée par ou avec un adulte superviseur.[4]  3 Prenez une lecture finale de la température de l'eau. Une fois que tout le carburant a brûlé ou que vous l'avez éteint, vous aurez besoin d'une deuxième lecture de la température. Utilisez le même thermomètre et insérez-le dans l'eau. Enregistrez la température finale à utiliser pour calculer l'énergie libérée par la combustion du carburant.
3 Prenez une lecture finale de la température de l'eau. Une fois que tout le carburant a brûlé ou que vous l'avez éteint, vous aurez besoin d'une deuxième lecture de la température. Utilisez le même thermomètre et insérez-le dans l'eau. Enregistrez la température finale à utiliser pour calculer l'énergie libérée par la combustion du carburant.  1 Trouvez la différence de température. Soustraire la température initiale de la température finale. Cela vous dira combien la température de l'eau a été modifiée par le combustible en dessous. Convertissez ce nombre en degrés Celsius si vos mesures ne sont pas en degrés Celsius.
1 Trouvez la différence de température. Soustraire la température initiale de la température finale. Cela vous dira combien la température de l'eau a été modifiée par le combustible en dessous. Convertissez ce nombre en degrés Celsius si vos mesures ne sont pas en degrés Celsius.  2 Multipliez la différence de température par la chaleur spécifique de l'eau. La chaleur spécifique de l'eau est la quantité de chaleur nécessaire pour élever la température de 1 gramme d'eau de 1 degré Celsius. Pour l'eau, la chaleur spécifique est de 1 calorie par gramme Celsius. Cela signifie qu'il faut 1 calorie pour chauffer 1 gramme d'eau de 1 degré Celsius.[5]
2 Multipliez la différence de température par la chaleur spécifique de l'eau. La chaleur spécifique de l'eau est la quantité de chaleur nécessaire pour élever la température de 1 gramme d'eau de 1 degré Celsius. Pour l'eau, la chaleur spécifique est de 1 calorie par gramme Celsius. Cela signifie qu'il faut 1 calorie pour chauffer 1 gramme d'eau de 1 degré Celsius.[5]  3 Facteur dans la masse de l'eau. Maintenant, multipliez le produit de la différence de chaleur et de la chaleur spécifique par la quantité d'eau que vous avez utilisée. Notez que 1 ml d'eau équivaut à 1 gramme d'eau. Assurez-vous que vous utilisez les unités grammes.[6]
3 Facteur dans la masse de l'eau. Maintenant, multipliez le produit de la différence de chaleur et de la chaleur spécifique par la quantité d'eau que vous avez utilisée. Notez que 1 ml d'eau équivaut à 1 gramme d'eau. Assurez-vous que vous utilisez les unités grammes.[6]  4 Réalisez que votre système perd de l'énergie. Alors qu'une partie de la chaleur dégagée va directement dans l'eau, votre système n'est pas parfait. De la chaleur sera perdue dans l'air ambiant. Une petite quantité de chaleur sera également absorbée par la boîte elle-même. Il y a peu à faire pour compenser la perte de chaleur.[7]
4 Réalisez que votre système perd de l'énergie. Alors qu'une partie de la chaleur dégagée va directement dans l'eau, votre système n'est pas parfait. De la chaleur sera perdue dans l'air ambiant. Une petite quantité de chaleur sera également absorbée par la boîte elle-même. Il y a peu à faire pour compenser la perte de chaleur.[7]